
【题目】有下列5种有机物
①![]() ②
②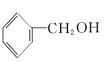 ③
③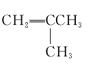 ④
④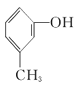 ⑤
⑤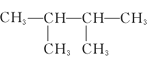
请回答下列问题:
(1)其中互为同系物的是____________和____________,互为同分异构体的是____________和____________(用序号回答)。
(2)用系统命名法给⑤命名,其名称为____________。
(3)有机物②核磁共振氢谱中有____________个峰。
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。
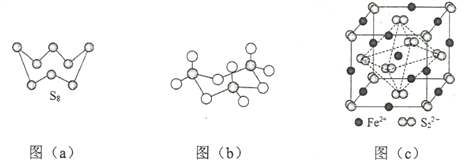
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于0.1 mol/L Na2SO3溶液,下列叙述正确的是
A. c(Na+) : c(SO32―) < 2 : 1
B. c(Na+) = 2 c (SO32―) + c(HSO3―) + c(H2SO3)
C. c(Na+) + c(H+) = 2 c (SO32―) + 2 c(HSO3―) + c(OH―)
D. 加入少量NaOH固体,c(SO32―) 与c(Na+) 均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于恒温、恒容下的反应 2A(g) + 2B(g)3C(g) + D(g),达到平衡状态的是
A. 单位时间内生成 2n mol A,同时生成 3n mol C
B. 单位时间内生成 n mol B,同时消耗 0.5n mol D
C. 容器内压强不随时间而变化
D. 容器内混合气体的密度不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分子中有10个氢原子的烷烃的分子式是________________________________。
(2)已知下列三种有机物:
A.苯 B.乙醇 C.乙酸
回答下列问题
①写出苯的结构简式____________;
②能使紫色石蕊溶液变红的是____________(填字母代号);
③医疗上常用体积分数为75%的____________(填字母代号)作消毒剂;
④写出选取上述两种有机物在浓硫酸和加热条件下反应制备乙酸乙酯的化学方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积为2L的容积不变的刚性密闭容器中,将2 mol 气体M和3 mol N气体混合,发生如下反应:2M(g)+3N(g)![]() xQ(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
xQ(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
A.x值为2
B.反应前与平衡时容器的压强之比为21:25
C.N的转化率为80%
D.混合气体平均摩尔质量不变,不能说明该反应达平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达平衡时,X的转化率为50%
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1molL-1的(NH4)2SO4溶液,用离子方程式表示该溶液显酸性的原因:___,在该溶液中各种离子浓度由大到小的顺序为___。
(2)B为0.1molL-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:__(用离子方程式和必要的文字说明)。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入__,目的是___;若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液(工业利用Cl2与NaOH反应制得)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 |
|
|
|
实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去。 | 混合后溶液pH=5.0,蓝色迅速褪去,无气体产生。 | 混合后溶液pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝。 |
A.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO+H+═HClO
B.实验③中产生的气体是Cl2,由HClO分解得到:2HClO═Cl2↑+H2O
C.对比实验②和③,溶液的pH可能会影响ClO的氧化性或Cl的还原性
D.加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH才能安全使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com