
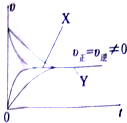
 研究碳、氮、硫及其化合物的性质具有重要意义.
研究碳、氮、硫及其化合物的性质具有重要意义.| 活性炭 | NO | E | F | |
| 起始 | 2.500 | 0.500 | 0 | 0 |
| T1 | 2.350 | 0.200 | 0.150 | 0.150 |
| T2 | 2.400 | 0.300 | 0.100 | 0.100 |
| [SO42-] |
| [CO32-] |
| [SO42-] |
| [CO32-] |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol?L-1) | 0.8 | 1.24 | 1.24 |
| A、①②④⑤ | B、②⑥ |
| C、②③④⑥ | D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14.7g | B、6.9g |
| C、12.1g | D、17.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含1molH2O的冰中含氢键数为2NA |
| B、12g金刚石中含有C-C键的个数为4NA |
| C、6g SiO2晶体中硅氧共价键数0.2NA |
| D、28gC2H4中含有的σ键为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种难溶物中溶解度小的物质其Ksp不一定小 |
| B、同种酸形成的酸式盐溶解度一定比正盐的溶解度大 |
| C、非金属性越强的元素其含氧酸酸性越强 |
| D、强电解质溶液的导电能力一定比弱电解质溶液导电能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 8 |
- 3 |
2- 4 |
- 3 |
| 实验编号 | ① | ② | ③ | ④ | ||
| 起始浓度c(I-)/(mol/L) | 0.040 | 0.080 | 0.080 | 0.080 | ||
起始浓度c(S2O
| 0.040 | 0.040 | 0.060 | 0.080 |
| A、① | B、② | C、③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸 | B、盐酸 |
| C、氢氧化钠 | D、硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com