
| A. | Ag是还原剂 | B. | O2被还原 | C. | H2S发生氧化反应 | D. | Ag2S是氧化产物 |
分析 4Ag+2H2S+O2═2Ag2S+2H2O,反应中Ag在反应中化合价升高,为还原剂,氧气在反应中化合价降低,为氧化剂,生成的Ag2S仅是氧化产物,H2O为还原产物,据此分析.
解答 解:A.Ag在反应中化合价升高,为还原剂,故A正确;
B.反应中O元素化合价降低,得电子被还原,故B正确;
C.反应中H、S元素的化合价没有变化,所以H2S既不是氧化剂又不是还原剂,没有发生还原反应,故C错误;
D.Ag在反应中化合价升高,为还原剂,则Ag2S是氧化产物,故D正确.
故选C.
点评 本题考查氧化还原反应,题目难度不大,注意从化合价变化的角度判断,注意该反应中S元素的化合价没有变化,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时,温度计水银球应放置在蒸馏烧瓶的支管口,以测量蒸气温度 | |
| B. | 实验室制备乙烯时,温度计水银球应放置在溶液中,以测量溶液温度 | |
| C. | 实验室制备乙烯时,可以使用体温计代替温度计控制溶液温度 | |
| D. | 控制反应温度在50-60℃之间比较好的方法是用水浴加热,用温度计控制水浴温度在50-60℃之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子的核外电子排布决定该元素在周期表中的位置 | |
| B. | 化学反应的焓变与其一定量的反应物、生成物内部所贮存的能量差异有关 | |
| C. | 同一周期元素原子最外层电子数越多,其元素的第一电离能越大 | |
| D. | 元素的非金属性越强其对应的而最高价含氧酸的酸性也越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水蒸发制海盐的过程是化学变化 | |
| B. | 海洋中有丰富的潮汐能、波浪能等新型能源 | |
| C. | 海水中提取溴单质的过程涉及氧化还原反应 | |
| D. | 海水淡化的方法主要有蒸馏法、离子交换法和电渗析发等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁、铝的熔点很高,可用于制耐火坩埚 | |
| B. | 小苏打受热分解生成气体,可用作发酵粉 | |
| C. | 铁的活泼性较强,铁粉可用作食品袋内的脱氧剂 | |
| D. | Na、Cu等金属化合物焰色反应呈现各种艳丽色彩,可制成节日烟花 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 溶液中加入盐酸,再滴加BaCl2溶液 | 先无现象,后产生白色沉淀 | 原溶液中有SO42- |
| B | 向两份蛋白质溶液中分别滴加饱和Na2SO4溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| C | 将Mg、Al与NaOH溶液组成原电池 | Mg电极溶解 | Mg比Al金属活动性强 |
| D | 向稀HNO3溶液中加入过量铁粉充分反应后,滴入KSCN溶液 | 溶液变为血红色 | 和HNO3具有氧化性,能将Fe氧化成Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
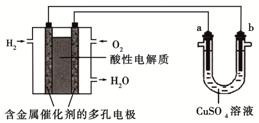
| A. | 燃料电池工作时,正极反应为:O2+2H2O+4e-═4OH- | |
| B. | a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 | |
| C. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | a、b两极均是石墨时,a极上产生的O2与电池中消耗的H2的体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| B. | 钢铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| C. | 绿色化学的核心是从源头上消除工业生产对环境的污染 | |
| D. | 汽油、柴油和植物油都是碳氢化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com