
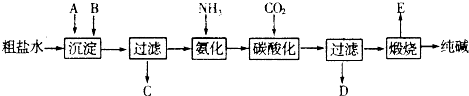
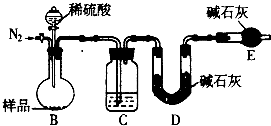
| ||
| ||
| 84(m1+m2-m3) |
| 31 |
| 84(m1+m2-m3) |
| 31 |
| 84(m1+m2-m3) |
| 31m2 |
| 84(m1+m2-m3) |
| 31m2 |


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:

| A、甲是亚硫酸氢钠粉末投入稀硝酸溶液中有关图象 |
| B、乙是等PH值的MCl2和NCl2溶液稀释时PH值变化图,由此可推测M的金属性较强 |
| C、由丙可知,双氧水在有催化剂存在时的热化学方程式为2H2O2(l)=2H2O(l)+O2(g)△H=-2(Ea2′-Ea2) kJ?mol-1 |
| D、丁是向硝酸银溶液中滴加氨水时,沉淀质量与氨的物质的量的关系图 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.| c(CH3COOH)?(OH-) |
| c(CH3COO-) |
| c(CH3COOH) |
| C(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①②③ |
| C、②③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体中氯气物质的量为0.04mol |
| B、混合气体中SO2物质的量为0.04mol |
| C、所得的沉淀为0.1mol BaSO4 |
| D、a的取值范围为0.896<a<1.792 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com