
根据表中信息判断,下列选项不正确的是()
序号 反应物 产物
① KMnO4、H2O2、H2SO4 K2SO4、MnSO4
② Cl2、FeBr2 FeCl3、FeBr3
③ MnO4﹣ Cl2、Mn2+
A. 第①组反应的 其余产物为H2O和O2
其余产物为H2O和O2
B. 第②组反应中参加反应的Cl2与 FeBr2的物质的量之比为1:2
C. 第③组反应中生成1mol Cl2,转移电子2mol
D. 氧化性由强到弱顺序为MnO4﹣>Cl2>Fe3+>Br2
考点: 氧化还原反应.
专题: 氧化还原反应专题.
分析: A、反应中KMnO4→MnSO4,Mn元素化合价由+7价降低为+2价,根据电子转移守恒,H2O2中氧元素化合价升高,应生成氧气,根据元素守恒还生成水.
B、由元素化合价可知,反应中只有亚铁离子被氧化,结构电子转移守恒计算判断.
C、由信息可知,MnO4﹣氧化Cl﹣为Cl2,Cl元素化合价由﹣1价升高为0价,转移电子的物质的量是氯气的2倍.
D、氧化剂氧化性强于氧化产物氧化性,由②可知Fe3+不能氧化Br﹣,氧化性Br2>Fe3+.
解答: 解:A、反应中KMnO4→MnSO4,Mn元素化合价由+7价降低为+2价,根据电子转移守恒,H2O2中氧元素化合价升高,生成氧气,根据H元素守恒可知还生成水,故A正确;
B、由元素化合价可知,反应中只有亚铁离子被氧化,根据电子转移守恒2n(C12)=n(FeBr2),即n(C12):n(FeBr2)=1:2,故B正确;
C、由信息可知,MnO4﹣氧化Cl﹣为Cl2,Cl元素化合价由﹣1价升高为0价,转移电子的物质的量是氯气的2倍,生成1mo1C12,转移电子为2mo1,故C正确;
D、氧化剂氧化性强于氧化产物氧化性,由③可知氧化性MnO4﹣>Cl2,由②可知氧化性Cl2>Fe3+,由②可知Fe3+不能氧化Br﹣,氧化性Br2>Fe3+,故D错误.
故选:D.
点评: 考查氧化还原反应的守恒与计算、氧化性与还原性强弱比较,难度中等,注意氧化还原反应中的守恒运用判断未知物.


 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
关于原电池和电解池的叙述正确的是()
A. 原电池中失去电子的电极为阴极
B. 原电池的负极、电解池的阳极都发生氧化反应
C. 原电池的两极一定是由活动性不同的两种金属组成
D. 电解时电解池的阴极一定是阴离子放电
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏德罗常数,下列叙述正确的是()
A. 标准状况下,22.4LH2O含有的分子数为 NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C. 通常状况下,NA 个CO2分子占有的体积为22.4L
D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣ 个数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
用98%的浓H2SO4(ρ=1.84g.cm﹣3)配制1mol/L的稀硫酸100mL,按配制溶液时仪器的选用顺序 排列,选择正确的是()
排列,选择正确的是()
①玻璃棒 ②胶头滴管 ③100mL容量瓶 ④托盘天平 ⑤50mL烧杯 ⑥10mL量筒 ⑦100mL量筒 ⑧移液管 ⑨滴定管.
A. ⑥③⑧⑤①② B. ⑥⑤③①⑨② C. ④⑤③②①⑨ D. ⑥⑤①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
一元中强酸次磷酸(H3PO2)是一种精细化工产品,下列说法正确的是()
A. 次磷酸的电离方程式为H3PO2⇌3H++PO23﹣
B. 次 磷酸中P的化合价为+1
磷酸中P的化合价为+1
C. NaH2PO2是酸式盐
D. NaH2PO2溶液显弱酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要配制0.1mol•L﹣1 CuSO4溶液480mL.
按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、 、 以及等质量的两片滤纸.
、 以及等质量的两片滤纸.
(2)计算,应选择下列正确
A.需要CuSO4固体8.0g B.需要CuSO4•5H2O晶体12.0g
C.需要CuSO4•5H2O晶体12.5g D.需要CuSO4固体7.7g
(3)称量.所用砝码生锈则所配溶液的浓度会偏高(填“偏高”、“偏低”或“无影响”).
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 .
(5)转移、洗涤.在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了 .
(6)定容,摇匀.
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度.
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶 液的浓度会 (填“偏高”、“偏低”或“无影响”).

查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语正确的是()
A. F结构示意图为: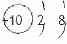
B. HCl的电子式为:H+
C. Na2O2的形成过程可以表示为: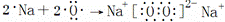
D. 次氯酸(HClO)的结构式为:H﹣Cl﹣O
查看答案和解析>>
科目:高中化学 来源: 题型:
银制器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故.根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去.下列说法正确的是()
A. 处理过程中银器一直保持恒重
B. 银器为正极,Ag2S被还原生成单质银
C. 该过程中总反应为2Al+3Ag2S═6Ag+Al2S3
D. 黑色褪去的原因是黑色Ag2S转化为白色AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
固体NH4Br置于密闭容器中,某温度下发生反应:NH4Br(s)⇌NH3(g)+HBr(g),2HBr(g)⇌Br2(g)+H2(g),2min后测知H2的浓度为0.5mol•L﹣1,HBr的浓度为4mol•L﹣1,若上述反应速率用v(NH3)表示,则下列速率正确的是()
A. 0.5mol•L﹣1•min﹣1 B. 2.5mol•L﹣1•min﹣1
C. 2mol•L﹣1•min﹣1 D. 1.25mol•L﹣1•min﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com