
在下列提供的试剂中,选择合适的试剂除去下表中各混合物的杂质(括号内物质为杂质),并按要求填写空格。
A.NaOH溶液 B.氨水 C.铁粉 D.稀盐酸 E.氯水 F.溴水
| 混合物(括号内为杂质) | 除杂试剂(填序号) | 反应离子方程式 |
| ①FeCl3(FeCl2) | ||
| ②Mg(Al) | ||
| ③ NaBr(NaI) | ||
| ④SiO2 (CaCO3) |
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
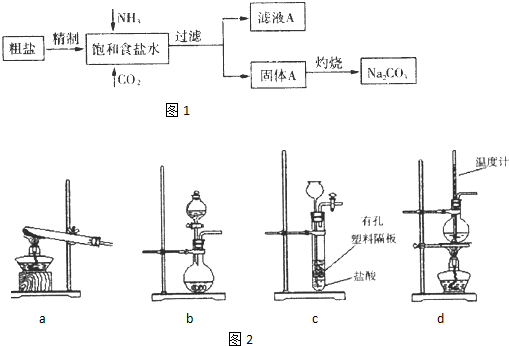
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
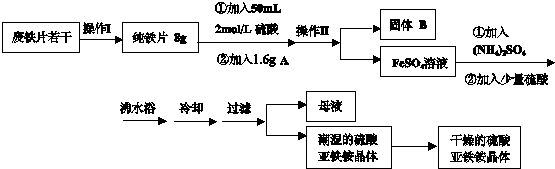
| 混合物 | 试剂 | 操作 | ①NaCl(SiO2) | ②Mg(Al) | ③Fe2O3(SiO2) |
查看答案和解析>>
科目:高中化学 来源:2012年鲁科版高中化学选修6 4.1 实验室制备日用化学品练习卷(解析版) 题型:填空题
某学生设计用动物油、乙醇、30%的NaOH溶液、NaCl饱和溶液和蒸馏水为试剂制取肥皂。试回答下列问题:
(1)实验台上已备有烧杯、量筒、酒精灯、铁架台、火柴等实验用品,尚缺少的仪器或用品是________________________________________________________________________
______________________。
(2)在提供的试剂中,加入乙醇的作用是
________________________________________________________________________
________________________________________________________________________,
加入NaOH溶液的作用是
________________________________________________________________________。
(3)实验原理的化学方程式是(有机物用结构简式)
________________________________________________________________________。
(4)证明皂化反应进行完全的方法是
________________________________________________________________________
________________________________________________________________________。
(5)皂化完成后,加入饱和NaCl溶液的作用是__________________,观察到的现象是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com