
 乳酸(
乳酸(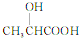 )是一种独特的调味剂,有很强的防腐、保鲜功效.常温下乳酸为无色液体,能与水、乙醇混溶.
)是一种独特的调味剂,有很强的防腐、保鲜功效.常温下乳酸为无色液体,能与水、乙醇混溶. .
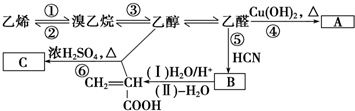
.分析 (1)将铜丝在空气中灼烧变黑后,迅速伸入乳酸中,铜和空气中的氧气在加热条件下反应生成黑色的氧化铜,氧化铜和乳酸中的醇羟基在加热条件下发生氧化还原反应生成铜、2-羰基丙酸、水;Cu参加化学反应,只是经过一系列的化学反应后又生成了红色的Cu,所以铜是催化剂;
(2)乳酸中的羧基在水溶液中电离溶液显酸性,可以依据酸性检验羧基的存在,如指示剂变色、和碳酸氢钠反应生成二氧化碳气体等;
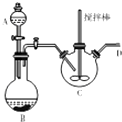
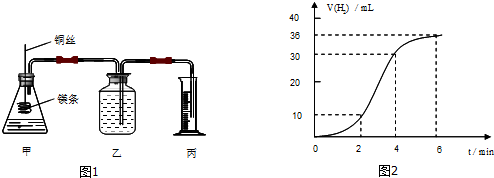
(3)①A中装有稀硫酸,烧瓶B中装有铁屑反应生成氢气,用来排除装置中的空气;
②亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与稀硫酸反应制备硫酸亚铁,利用反应生成的氢气排尽装置中的空气,故B制备氯化亚铁,向三颈瓶C中加人碳酸亚铁固体和乳酸溶液并加热至75℃,反应生成[CH3CH(OH)COO]2Fe(乳酸亚铁)、二氧化碳和水;
③尾气为剩余氢气,排放空气中易发生爆炸,需要用点燃的方法除去尾气处理;
④乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大.
解答 解:(1)铜和空气中的氧气在加热条件下反应生成黑色的氧化铜,所以在酒精灯外焰灼烧铜丝观察到铜丝表面变黑,发生2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO①反应,乙醇有还原性,氧化铜有氧化性,氧化铜和乳酸中的醇羟基在加热条件下发生氧化还原反应生成铜和羰基酸、水,实质是Cu参加化学反应,只是经过一系列的化学反应后又生成了红色的Cu,所以铜是催化剂,黑色又变化为红色,反应的化学方程式为: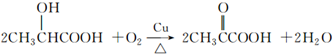 ,
,
故答案为:红色;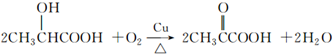 ;
;
(2)乳酸中的羧基在水溶液中电离溶液显酸性,可以依据酸性检验羧基的存在,如指示剂变色、和碳酸氢钠反应生成二氧化碳气体等,证明乳酸分子中含有羧基的操作为:取少量乳酸,加入几滴石蕊试液,若呈红色,证明乳酸分子中含有羧基.或:取少量乳酸,加入碳酸氢钠溶液,若有气泡产生,证明乳酸分子中含有羧基,
故答案为:取少量乳酸,加入几滴石蕊试液,若呈红色,证明乳酸分子中含有羧基或取少量乳酸,加入碳酸氢钠溶液,若有气泡产生,证明乳酸分子中含有羧基;
(3)①A中装有稀硫酸,烧瓶B中装有铁屑,仪器A、B组成的装置的作用是利用稀硫酸和铁反应生成硫酸亚铁和氢气,氢气可以排除装置C中的空气,避免亚铁离子被氧化,
故答案为:用氢气排除装置内的空气,防止Fe2+被氧化;
②亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与稀硫酸反应制备硫酸亚铁,利用反应生成的氢气排尽装置中的空气,故B制备氯化亚铁,向三颈瓶C中加人碳酸亚铁固体和乳酸溶液并加热至75℃,反应生成[CH3CH(OH)COO]2Fe(乳酸亚铁)、二氧化碳和水,反应的化学方程式为:2CH3CH(OH)COOH+FeC03=[CH3CH(OH)COO]2Fe+C02+H20,
故答案为:2CH3CH(OH)COOH+FeC03=[CH3CH(OH)COO]2Fe+C02+H20;
③尾气为剩余氢气,排放空气中易发生爆炸,需要用点燃的方法除去尾气处理,在导气管口放置一个燃着的酒精灯以除去放出的氢气
故答案为:放置一个燃着的酒精灯以除去放出的氢气;
④乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,由:Ce4++Fe2+=Ce3++Fe3+,可知溶液中n(Fe2+)=n(Ce4+),计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大,产品中乳酸亚铁的质量分数会大于100%,
故答案为:KMnO4具有强氧化性,可能将Fe2+和乳酸亚铁的羟基一同氧化.
点评 本题考查实验制备方案,涉及化学仪器识别、对操作的分析评价、物质分离提纯、氧化还原反应滴定应用等,明确原理是解题关键,是对学生综合能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
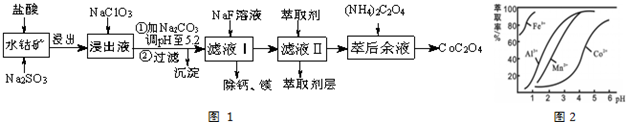
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 硫在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
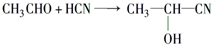 ;加成反应.
;加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
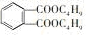 ),过量摄入塑化剂会对肝肾功能造成影响,甚至诱发癌症.下列有关说法正确的是( )
),过量摄入塑化剂会对肝肾功能造成影响,甚至诱发癌症.下列有关说法正确的是( )| A. | DBP的分子式为C16H22O4 | |
| B. | 1mol DBP可以与5molH2反应 | |
| C. | 1mol DBP在碱性条件下水解时消耗4molNaOH | |
| D. | DBP所有原子在同一平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
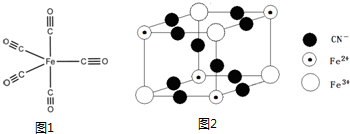
| A. | 在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数 | |
| B. | 在金刚石晶体中,围成最小环的原子数 | |
| C. | 在二氧化硅晶体中,围成最小环的硅原子数 | |
| D. | 在CsCl晶体中,与一个Cs+最近的且距离相等的Cl-的个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
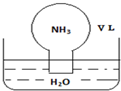 标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法正确的是( )
标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法正确的是( )| A. | 条件不足,不能计算所得溶液的物质的量浓度 | |
| B. | 所得溶液中,n(NH3•H2O)+n(NH4+)=$\frac{V}{22.4}$ mol | |
| C. | 所得溶液的质量分数为$\frac{17}{22400}$ρ | |
| D. | 水最终不可能充满整个烧瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com