
【题目】下列图象不正确的是
A. 向100ml0.1mol·L-1H2SO3溶液中滴加0.1mol·L-1Ba(OH)2溶液至过量
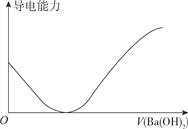
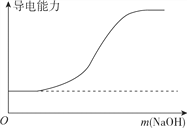
B. 向100ml0.1mol·L-1H2SO4溶液中加入NaOH固体
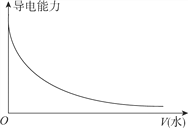
C. 向一定浓度的氯化钠溶液中加水
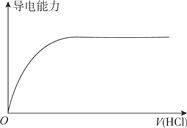
D. 向蒸馏水中通入HCl气体
【答案】A
【解析】A. H2SO3是弱酸,H2SO3溶液的导电性较弱,滴加Ba(OH)2溶液生成BaSO3沉淀和水,溶液的导电性降低,完全反应时,纯水几乎不导电,继续滴加过量Ba(OH)2溶液,溶液导电性增强,故A正确;B. H2SO4是强酸,向100ml0.1mol·L-1H2SO4溶液中加入NaOH固体,在完全中和前导电性几乎不变,过量的NaOH固体使反应后溶液的导电性增强,故B正确;C. 向一定浓度的氯化钠溶液中加水稀释,单位体积内自由移动的离子数目降低,导电性减弱,故C正确;D. 蒸馏水几乎不导电,但HCl的水溶液盐酸是强电解质的水溶液,导电性较强,由向蒸馏水中通入HCl气体时溶液的导电性不断增强,故D错误;答案为D。


科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种常见的强氧化剂。实验室以精选铬铁矿(主要成分可表示FeO·Cr2O3,还含有 SiO2、 Al2O3 等杂质)为原料制备重铬酸钾晶体(K2Cr2O7,式量294)的流程如下:

请回答下列问题:
操作1中发生的反应有:
4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;Na2CO3+SiO2
2NaAlO2+CO2↑;Na2CO3+SiO2![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
该步骤在常温下的反应速度较慢,为使反应速率增大,可采取的两条措施是____________。
(2)固体Y 中主要含有______________。(填写化学式)
(3)酸化步骤使含铬物质发生了转化,请写出离子反应方程式______________________。
(4)操作 4 中的化学反应在溶液中能发生的可能理由是_________________________;获得 K2Cr2O7 晶体的操作依次是:加入KCl 固体,在水浴上加热浓缩至______________,冷却结晶,抽滤,洗涤,干燥。
(5)通过下列实验可测定产品中重铬酸钾的质量分数:称取重铬酸钾试样 1.470g,用100mL 容量瓶配制成溶液。移取25.00mL 溶液于碘量瓶中,加入适里稀硫酸和足量碘化钾(铬的还原产物为 Cr3+),放于暗处 5min。然后加入一定量的水,加入淀粉指示剂,用0.1500mol/L 标准溶液滴定,共消耗标准液36.00mL。滴定时发生的反应的离子方程式为:I2+2S2O32-=2I-+S4O62-;则所测产品中重铬酸钾的纯度为_____________。
(6)有关上述实验过程中涉及的部分实验操作的描述,正确的是_________.
A.粗产品若要进一步提纯,可以采用重结晶的方法
B. 配制溶液时,用托盘天平称取试样后,一般经溶解、转移(含洗涤)、定容等步骤,配制成100mL溶液
C.滴定时,当最后一滴标准溶液滴入时,溶液变为蓝色,且半分钟内不变色,可判断滴定终点
D.滴定终点时俯视读数,测定结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾(FeSO4·7H2O)的流程如下:
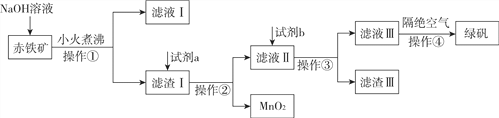
(1)滤液Ⅰ中所含的阴离子有________。
(2)试剂a为________,试剂b投入到滤液Ⅱ发生的所有反应的化学方程式为________。
(3)实验室中操作①所需的玻璃仪器有________。
(4)操作④的名称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500℃左右的铁屑中通入Cl2生产无水氯化铁,其制备过程中均要确保无水。现模拟该过程用图示装置进行实验:

(1)仪器a的名称为________,装置A的圆底烧瓶中发生反应的化学方程式为________,为保持装置C为无水环境,装置B中加入的试剂是________。
(2)实验步骤:如图连接装置后,先________(填实验操作),再装药品,然后点燃________(填“A”或“C”)处酒精灯,当________(填实验现象)时,再点燃________(填“A”或“C”)处酒精灯。
(3)装置D的作用是________,________。
(4)甲同学认为进入装置C的气体中混有HCl,应在装置B前增加装有________(填试剂名称)的洗气装置除去;乙同学认为不需要除去HCl,理由为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=akJ/mol
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98kJ/mol
则a为_____________。
(2)反应2NH3(g)+CO2(g) ![]() CO(NH2)2(l)+H2O(g)在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(l)+H2O(g)在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
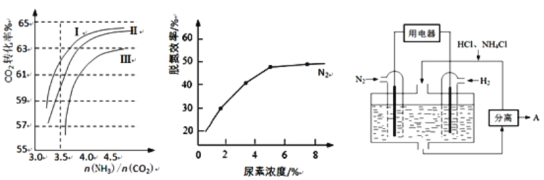
图1 图2 图3
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:
A.0.6~0.7 B.1~1.1 C.1.5~1.61
生产中应选用水碳比的数值为_____________(选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是_____________。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=________(空气中氧气的体积含量大约为20%)。
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为________%。
(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式_____________。生产中可分离出的物质A的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备单质硅时,主要化学反应如下:①SiO2+2C=Si+2CO↑;②Si+2Cl2=SiCl4;③SiCl4+2H2=Si+4HCl。下列对上述三个反应的叙述中,不正确的是( )
A.①③为置换反应
B.①②③均为氧化还原反应
C.②为化合反应
D.三个反应的反应物中硅元素均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.理论上任何氧化还原反应都可以设计成原电池。
B.甲烷的标准燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g)△H=-38.6 kJ/mol
2NH3(g)△H=-38.6 kJ/mol
D.同温同压下,等量的氢气完全发生反应:H2(g)+Cl2(g)=2HCl(g),在点燃条件下放出的热量与光照条件下放出的热量相等。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com