
【题目】某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程. 【实验】在0.1molL﹣l MgSO4 , 0.05molL﹣l﹣Al2( SO4)3的混合溶液中滴加0.5mol.L﹣1NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.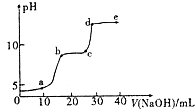
(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于(填仪器名称)中滴加.
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是 .
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,小组同学做出如下推测,请补充推测2和3: 推测l:生成Mg( OH)2沉淀,消耗OH ﹣;
推测2:;
推测3.
若推测l符合实际情况,则a点之前反应的离子方程式为一,请据此描述Mg( OH)2 , A1( OH)3两种物质在水溶液中溶解性的差异.
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
较大量存在的含金属元素的离子 | 检验方法 |
【答案】
(1)碱式滴定管
(2)生成白色沉淀并逐渐增多
(3)生成Al(OH)3沉淀消耗OH﹣;Al(OH)3沉淀溶解,消耗OH﹣
(4)Na+;用洁净的铂丝蘸取少量待测液在酒精灯火焰上灼烧,若火焰呈黄色,表明存在Na+;[Al(OH)4]﹣;取少量待测液于试管中,滴加盐酸,产生白色沉淀,盐酸过量时,沉淀又溶解
【解析】解:(1)精确控制加入NaOH溶液的体积,应用精确度0.01ml的滴定管,又NaOH呈碱性,故选用碱式滴定管,所以答案是:碱式滴定管;(2)由图象可知,PH变化缓慢的主要原因应为:生成Mg(OH)2沉淀,消耗OH﹣;生成Al(OH)3沉淀消耗OH﹣; Al(OH)3沉淀溶解,消耗OH﹣三种可能,第一阶段(a点前)应该是生成沉淀消耗了滴下去的氢氧化钠,故现象为:生成白色沉淀并逐渐增多,所以答案是:生成白色沉淀并逐渐增多;(3)根据分析可知,PH变化缓慢的主要原因应为:生成Mg(OH)2沉淀,消耗OH﹣;生成Al(OH)3沉淀消耗OH﹣; Al(OH)3沉淀溶解,消耗OH﹣三种可能,若推测1符合实际情况,b、c之间生成Mg(OH)2沉淀,消耗OH﹣ , 则a点之前应该是产生氢氧化铝的反应,所以反应的离子方程式为Al3++3OH﹣═Al(OH)3↓,据此说明在碱性溶液中铝离子比镁离子更易沉淀,所以Al(OH)3比Mg(OH)2更难溶于水, 故答案:生成Al(OH)3沉淀消耗OH﹣;Al(OH)3沉淀溶解,消耗OH﹣;Al3++3OH﹣═Al(OH)3↓;Al(OH)3比Mg(OH)2更难溶于水;(4)根据以上分析得出,e点前的反应为Al(OH)3+OH﹣═Al(OH)4﹣ , 所以e点后溶液中较大量存在的含金属元素的离子为钠离子和Al(OH)4﹣离子,所以答案是:
较大量存在的含金属元素的离子 | 检验方法 |
Na+ | 用洁净的铂丝蘸取少量待测液在酒精灯火焰上灼烧,若火焰呈黄色,表明存在Na+ |
[Al(OH)4]﹣ | 取少量待测液于试管中,滴加盐酸,产生白色沉淀,盐酸过量时,沉淀又溶解 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知下列物质在20℃下的Ksp如下:
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 2.0X10﹣10 | 5.4X10﹣13 | 8.3X10﹣17 | 2.0X10﹣41 | 2.0X10﹣12 |
下列说法不正确的是( )
A.20℃时.AgCl饱和溶液和Ag2CrO4饱和溶液中.Ag+物质的量浓度由大到小的顺序是Ag2CrO4>AgCl
B.20℃时,向相同浓度的KCl和KBr混合溶液中逐滴滴加AgNO3溶液.会先生成浅黄色沉淀
C.20℃时,向相同浓度的KCl和KBr混合溶液中逐滴滴加AgNO3溶液,当两种沉淀共存时.c(Br﹣):C(C1﹣)=2.7×10﹣3
D.在100ml AgCl、AgBr、AgI饱和的混合溶液中加入足量浓AgNO3溶液,产生沉淀AgI质量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离.但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4﹣ , HSO4﹣![]() H++SO42﹣ .
H++SO42﹣ .
请回答下列有关问题:
(1)Na2SO4溶液呈(填“弱酸性”、“中性”或“弱碱性”),其理由是(用离子方程式表示);
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为:
(3)在0.10mol/L的Na2SO4溶液中,下列离子浓度关系正确的是________(填写编号);
A.c(SO42﹣)+c(HSO4﹣)+c(H2SO4)=0.1mol/L
B.c(OH﹣)=c(H+)+c(HSO4﹣)
C.c(Na+)+c(H+)=c(OH﹣)+c(HSO4﹣)+2c(SO42﹣)
D.c(Na+)>c(SO42﹣)>c(OH﹣)>c(HSO4﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应过程不符合下图关系的是( )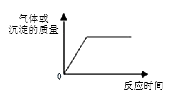
A.向一定量铜片中加入过量浓硝酸
B.向一定量AlCl3溶液通入过量NH3
C.向一定量澄清石灰水中通入过量CO2
D.向一定量MgCl2溶液中滴加过量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~J分别代表相关反应的一种物质,图中有部分生成物未标出.
已知:A分解得到等物质的量的B,C,D;反应①为:2Mg+CO2 ![]() 2MgO+C.
2MgO+C.
(1)A的化学式 .
(2)写出反应②的化学方程式: .
(3)写出反应③的离子方程式: .
(4)写出反应⑤的化学方程式: .
(5)在反应④中,当生成标准状况下2.24L G时,转移电子mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组的同学们利用下图装行研究Na2O2与干燥CO2是否发生反应。(部分夹持仪器略去)请回答下列问题。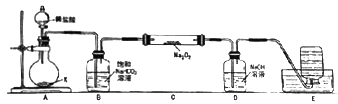
(1)药品X是,盛装X的仪器名称是。
(2)装置B的作用是。
(3)装置C中发生反应的化学方程式是。
(4)将E中集满气体后,欲检验该气体.应先关闭A中的活塞,将E中导管移出水面,接下来的操作是。
(5)你认为以上实验能否达到实验目的?理由是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.室温下,0.001 molL﹣1的醋酸中由水电离的c(H+)=10﹣11molL﹣1
B.Na2CO3溶液中存在c(Na+)+c(H+)═c(OH﹣)+a c(X)+b c(Y),若X为HCO3﹣ , 则b=2
C.某温度下,浓度均为0.01molL﹣1的盐酸和氢氧化钠溶液的pH分别为2和12
D.向0.1molL﹣1氯化铵溶液滴加几滴浓盐酸,c(NH4+)减小,PH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com