
【题目】氮和磷元素的单质和化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列问题:
(1)科学家合成了一种阳离子为“N5n+”,其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,其电子式为___,其中的阴离子的空间构型为___。
(2)2001年德国专家从硫酸铵中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子的形式存在。N4H44+根系易吸收,但它遇到碱时会生成类似白磷的N4分子,不能被植物吸收。1个N4H44+中含有___个σ键。
(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因___。
(4)P4S3可用于制造火柴,其分子结构如图1所示。
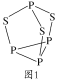
①P4S3分子中硫原子的杂化轨道类型为___。
②每个P4S3分子中含孤电子对的数目为___。
(5)某种磁性氮化铁的晶胞结构如图2所示,该化合物的化学式为___。若晶胞底边长为anm,高为cnm,则这种磁性氮化铁的晶体密度为__g·cm3(用含a、c和NA的式子表示)

(6)高温超导材料,是具有高临界转变温度(Te)能在液氮温度条件下工作的超导材料。高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为[Ar]__;化合物中,稀土元素最常见的化合价是+3,但也有少数的稀土元素可以显示+4价,观察下面四种稀土元素的电离能数据,判断最有可能显示+4价的稀土元素是___(填元素符号)。
几种稀土元素的电离能(单位:kJ·mol1)
元素 | I1 | I2 | I3 | I4 |
Sc(钪) | 633 | 1235 | 2389 | 7019 |
Y(铱) | 616 | 1181 | 1980 | 5963 |
La(镧) | 538 | 1067 | 1850 | 4819 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
【答案】![]() 直线形 10 N的电负性强于P,对成键电子对吸引能力更强,成键电子对离中心原子更近,成键电子对之间距离更小,排斥力更大致使键角更大,因而PH3的键角小于NH3(或氮原子电负性强于磷原子,PH3中P周围的电子密度小于NH3中N周围的电子密度,故PH3的键角小于NH3) sp3 10 Fe3N
直线形 10 N的电负性强于P,对成键电子对吸引能力更强,成键电子对离中心原子更近,成键电子对之间距离更小,排斥力更大致使键角更大,因而PH3的键角小于NH3(或氮原子电负性强于磷原子,PH3中P周围的电子密度小于NH3中N周围的电子密度,故PH3的键角小于NH3) sp3 10 Fe3N 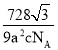 ×1021 3d8 Ce
×1021 3d8 Ce
【解析】
(1)、N5结构是对称的,5个N排成V形,5个N结合后都达到8电子结构,且含有2个N=N键,满足条件的结构为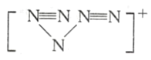 ,故“Ns”带一个单位正电荷。因此化学式为 “N8”的离子晶体是由N5+和N3-形成的,电子式为
,故“Ns”带一个单位正电荷。因此化学式为 “N8”的离子晶体是由N5+和N3-形成的,电子式为![]() ,其中的阴离子和CO2互为等电子体,则其空间构型为直线形。
,其中的阴离子和CO2互为等电子体,则其空间构型为直线形。
(2)、N4与白磷的结构类似,因此N2H44+的结构式为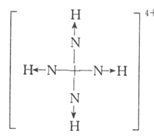 ,所以1个N2H44+中含有10个σ键。
,所以1个N2H44+中含有10个σ键。
(3)由于N的电负性强于P,对成键电子对的吸引能力更强,成键电子对离中心原子更近,成键电子对之间距离更小,排斥力更大致使键角更大,因而PH3的键角小于NH3。
(4)①、P4S3分子中硫原子的价层电子对数是4,含有2对孤电子对,杂化轨道类型为sp3;
②、分子中每个P含有1对孤对电子,每个S含有2对孤电子对,则每个P4S3分子中含孤电子对的数为4×1+3×2=10。
(5)、根据均摊法在氮化铁晶胞中,含有N原子数为2,Fe原子数为![]() ,所以氮化铁的化学式Fe3N,若晶胞底边长为a nm,高为c nm,则晶胞的体积是
,所以氮化铁的化学式Fe3N,若晶胞底边长为a nm,高为c nm,则晶胞的体积是![]() ,所以这种磁性氮化铁的晶体密度为
,所以这种磁性氮化铁的晶体密度为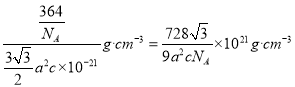 。
。
(6)、铜的原子序数是29,基态时Cu3+的电子排布式为[Ar]3d8;根据表中数据可知Ce的第三电离能与第四电离能相差最小,所以最有可能显示+4价的稀土元素是Ce。


科目:高中化学 来源: 题型:
【题目】已知某有机物X的结构简式如图所示,下列有关叙述不正确的是( )

A.X的化学式为C10H10O6
B.X在一定条件下能与FeCl3溶液发生显色反应
C.1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、4 mol、1 mol
D.X在一定条件下能发生消去反应和酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯为主要原料合成重要的有机化合物路线如下图所示。请回答下列问题。
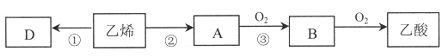
(1)乙烯的结构简式__________________,空间构型_____________________。
(2)A物质所含官能团的名称是____________________。
(3)反应②的反应类型是__________________________。
(4)反应③的化学方程式是___________________________________________。
(5)以乙烯为原料可合成有机高分子化合物D,反应①的化学方程式是___________________。
(6)下列物质中,可以通过乙烯加成反应得到的是___________(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述错误的是( )
A. 1.8gH2O中含有的质子数为NA
B. 22.4L氯气与足量镁粉充分反应,转移的电子数为2NA
C. 46gNO2和N2O4混合气体中含有原子总数为3NA
D. 23gNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.根据如图给出的装置图回答下列问题:
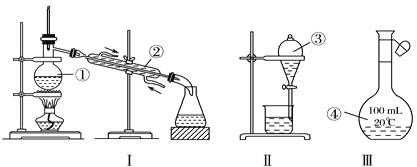
(1)写出图中玻璃仪器的名称:①____;②____;③_____。
(2)①~④中,使用前必须检查是否漏水的是___、___(填仪器序号),分离溴水中的溴应先选择装置___(填Ⅰ、Ⅱ或Ⅲ序号)。
Ⅱ.某同学帮助水质检测站配制480mL0.5mol·L-1NaOH溶液备用。请回答下列问题:
(1)该同学用到的玻璃仪器有烧杯、量筒、玻璃棒、___、胶头滴管。
(2)该同学用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体,则称取的总质量为___克。
(3)配制时,其正确的操作顺序如下,请填充所缺步骤。
A.在盛有NaOH固体的烧杯中加入适量水溶解;
B.将烧杯中冷却的溶液沿玻璃棒注入容量瓶中;
C.用少量水___2次~3次,洗涤液均注入容量瓶,振荡。
D.继续往容量瓶内小心加水,直到液面接近刻度___处,改用胶头滴管加水,使溶液___。
E.将容量瓶盖紧,反复上下颠倒,摇匀。
(4)若出现如下情况,其中将引起所配溶液浓度偏低的是____(填编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干 ②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤C ④加蒸馏水时不慎超过了刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
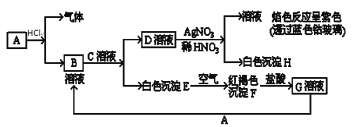
【题目】以下物质相互转化
试回答:
(1)写出B的化学式________________;D的名称________________。
(2)写出由E转变成F的化学方程式________________。
(3)写出用KOH鉴别G溶液的离子方程式________________;向G溶液加入A的有关离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V 1 mL 0.1mol·L-1的Fe2(SO4)3溶液与2mL 0.1mol·L-1KI溶液混合,待充分反应后,下列方法可证明该反应具有一定限度的是( )
A.若V1<1,加入淀粉B.若V1≤1,加入KSCN溶液
C.若V1≥1,加入AgNO3溶液D.加入Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在通常条件下能一步转化的全部组合是
序号 | X | Y | Z | W |
|
Al | NaAlO2 | Al(OH)3 | Al2O3 | ||
② | Na | NaOH | Na2CO3 | NaCl | |
③ | C | CO | CO2 | H2CO3 | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①② B. ①③④ C. ②③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾别名青矾、皂荚矾等,是我国古代常用的药材,以硫铁矿[主要成分为二硫化亚铁(FeS2)]为原料制备绿矾晶体,工艺流程如下:
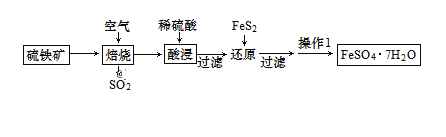
下列说法正确的是
A.焙烧过程中每生成1molSO2转移电子数为5.5NA
B.还原后所得滤液可用高锰酸钾检验Fe3+是否反应完全
C.为中和还原后滤液中过量的酸,可加入一定量FeCO3
D.操作1为蒸发结晶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com