
| A. | 加入铝能放出H2的溶液中:NH4+、Na+、Cl-、Br- | |
| B. | 水电离出的c(H+)=10-13mol•L-1的溶液中:Fe3+、K+、CO32-、SO32- | |
| C. | 室温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol•L-1的溶液中:Al3+、Na+、SiO32-、HCO3- | |
| D. | 使石蕊变红的溶液中:Fe2+、K+、ClO-、SO42- |
分析 A.加入铝能放出H2的溶液,为非氧化性酸或强碱溶液;
B.水电离出的c(H+)=10-13mol•L-1的溶液,为酸或碱溶液;
C.室温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol•L-1的溶液,显碱性;
D.使石蕊变红的溶液,显酸性.
解答 解:A.加入铝能放出H2的溶液,为非氧化性酸或强碱溶液,酸溶液中该组离子之间不反应,可大量共存,故A选;
B.水电离出的c(H+)=10-13mol•L-1的溶液,为酸或碱溶液,碱溶液不能大量存在Fe3+,酸溶液中不能存在CO32-、SO32-,故B不选;
C.室温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol•L-1的溶液,显碱性,不能大量存在Al3+、HCO3-,且相互促进水解不能共存,故C不选;
D.使石蕊变红的溶液,显酸性,Fe2+、H+、ClO-发生氧化还原反应,不能共存,故D不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


科目:高中化学 来源: 题型:解答题
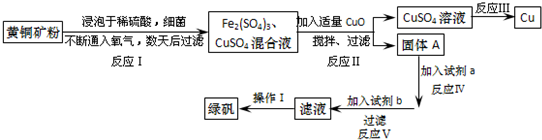
| Fe2+ | Cu2+ | Fe3+ | |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X、Y与Z的原子半径大小:Y>Z>X | |
| B. | 元素W、Z的氯化物中,化学键类型相同,且各原子均满足8电子 | |
| C. | 元素X与元素Y形成的化合物是一种较好的耐火材料 | |
| D. | 元素X可与元素Z可组成3种二价阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA | |
| B. | 1mol Na218O2中所含的中子数为42NA | |
| C. | 28g铁粉与足量稀硝酸反应,转移的电子数为NA | |
| D. | 1mol环己烷中含有的共价键数为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液的方法可以分离汽油和水 | |
| B. | 酒精灯加热试管时须垫石棉网 | |
| C. | NH3能使湿润的蓝色石蕊试纸变红 | |
| D. | 盛放NaOH溶液的广口瓶,可用玻璃塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2均能与盐酸反应生成NaCl,二者都是碱性氧化物 | |
| B. | Na2O2在空气中易变质,需要密封保存,Na2O性质稳定,不必密封保存 | |
| C. | 在呼吸面具中,Na2O2能做供氧剂,而Na2O不能 | |
| D. | 将Na2O2放入氢氧化钠溶液中,不发生反应,无明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com