
A、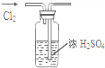 干燥Cl2 干燥Cl2 |
B、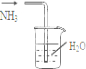 吸收NH3 |
C、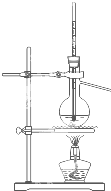 制取蒸馏水 |
D、 吸收SO2 吸收SO2 |


科目:高中化学 来源: 题型:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
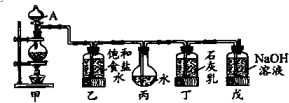
| 实验装置 | 实验现象 |
| 步骤1:将干燥的红布条投入到装有干燥氯气的集气瓶 | 发现有色布条不褪色 |
| 步骤2:将新制的饱和氨水等分成两份分装于A、B两试管 |  |
| 步骤3:向B中加入足量NaHCO3固体 |  |
| 步骤4:同时向A、B两试管加入相同大小的红布条,观察褪色的先后顺序 | B试管褪色所需时间短 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
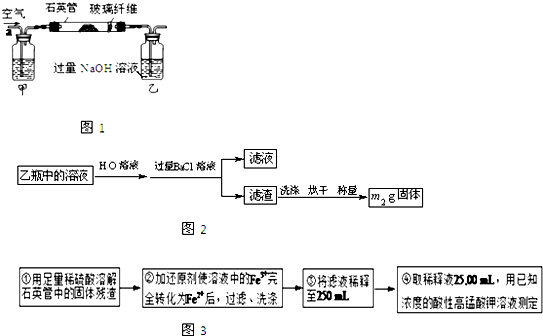
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用分液漏斗分离硝基苯和水的混合物 |
| B、除去苯中的少量苯酚,可加入浓溴水后过滤 |
| C、银镜反应实验后试管内壁附有银,可用氨水清洗 |
| D、可用酸性高锰酸钾溶液鉴别已烯、甲苯、乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com