
【题目】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态 Cl原子核外电子排布式为__________________________,P、S、Cl的第一电离能由大到小顺序为____________________,P、S、Cl的电负性由大到小顺序为_______________。
(2)SCl2分子中的中心原子杂化轨道类型是_____________,该分子构型为__________。
(3)Ni与CO能形成配合物Ni(CO)4,该分子中配位键个数为_______;以“—”表示σ键、“→”表示配位键,写出CO分子的结构式__________。
(4)已知MgO与NiO的晶体结构(如图1)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_______________________________。

(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______。
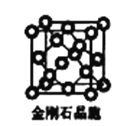
(6)金刚石晶胞含有____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(请用r和a表示不要求计算结果)。
【答案】1s22s22p63s23p5 Cl> P > S Cl> S > P sp3 V形 8 ![]() > Mg2+半径比Ni2+小,MgO的晶格能比NiO大 (1,
> Mg2+半径比Ni2+小,MgO的晶格能比NiO大 (1,![]() ,
,![]() ) 8
) 8 ![]()
![]()
【解析】
(1)Cl为17号元素,结合核外电子的排布规律书写基态 Cl原子的电子排布式;同周期随原子序数增大,元素第一电离能呈增大趋势,半满稳定状态,能量较低,第一电离能高于同周期相邻元素;元素的非金属性越强,电负性数值越大;
(2)根据价层电子对个数=σ键个数+孤电子对个数计算SCl2中S原子杂化轨道数分析解答;
(3)CO分子中C与O之间形成三键,其中有一个为配位键,CO与中心原子间形成4个配位键,据此解答;
(4)Mg2+半径比Ni2+小,结合晶格能的大小分析判断;
(5)根据图示,C离子的x系坐标与B的x系坐标相同,y、z系坐标都在中点上;
(6)金刚石晶胞中有4个碳原子位于晶胞内部,每个顶点每个面心上各有1个原子;碳原子与周围相接触的4个碳原子形成正四面体,顶点碳原子与正四面体中心碳原子连线处于晶胞体对角线上,二者距离等于晶胞体对角线长度的![]() ,据此计算r,从而计算该晶胞中所有C原子的体积和晶胞体积,结合原子空间利用率=
,据此计算r,从而计算该晶胞中所有C原子的体积和晶胞体积,结合原子空间利用率=![]() 分析计算。
分析计算。
(1)Cl为17号元素,基态 Cl原子的电子排布为1s22s22p63s23p5;同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:Cl>P>S;元素的非金属性越强,电负性数值越大,P、S、Cl的电负性由大到小顺序为Cl> S > P,故答案为:1s22s22p63s23p5;Cl>P>S;Cl> S > P;
(2)SCl2中S原子杂化轨道数为2+![]() (6-2)=4,采取sp3杂化,含有两对孤电子对,所以该分子构型为V形,故答案为:sp3;V形;
(6-2)=4,采取sp3杂化,含有两对孤电子对,所以该分子构型为V形,故答案为:sp3;V形;
(3)Ni与CO能形成配合物Ni(CO)4,1个CO中含有1个配位键,CO与中心原子间形成4个配位键,因此一个Ni(CO)4分子中8个配位键;CO分子中C与O之间形成三键,其中有一个为配位键,CO分子的结构式为![]() ,故答案为:8;
,故答案为:8;![]() ;
;
(4)Mg2+半径比Ni2+小,所以氧化镁的晶格能大于氧化镍,则熔点:MgO>NiO,故答案为:>;Mg2+半径比Ni2+小,MgO的晶格能比NiO大;
(5)NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),而C离子的x系坐标与B的x系坐标相同,y、z系坐标都在中点上,所以C离子坐标参数为(1,![]() ,
,![]() ),故答案为:span>(1,
),故答案为:span>(1,![]() ,
,![]() );
);
(6)金刚石晶胞中有4个碳原子位于晶胞内部,每个顶点每个面心上各有1个原子,该晶胞中C原子个数=8×![]() +6×
+6×![]() +4=8;碳原子与周围相接触的4个碳原子形成正四面体,顶点碳原子与正四面体中心碳原子连线处于晶胞体对角线上,且二者距离等于晶胞体对角线长度的
+4=8;碳原子与周围相接触的4个碳原子形成正四面体,顶点碳原子与正四面体中心碳原子连线处于晶胞体对角线上,且二者距离等于晶胞体对角线长度的![]() ,晶胞体对角线长度等于晶胞边长的
,晶胞体对角线长度等于晶胞边长的![]() 倍,则2r=
倍,则2r=![]() a,则r=
a,则r=![]() a;该晶胞中所有C原子体积=8×
a;该晶胞中所有C原子体积=8×![]() πr3、晶胞体积=a3,原子空间利用率=
πr3、晶胞体积=a3,原子空间利用率=![]() =
=![]() =
=![]() =
=![]() π,故答案为:8;
π,故答案为:8;![]() ;
;![]() π。
π。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是

A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1:1和1:2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是_____。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为:NH3+Cl2﹣N2+HCl
①该反应中被氧化的元素是_____(填元素名称),氧化剂是_____(填化学式)。
②配平该方程式:_____NH3+_____Cl2=_____N2+_____HCl
(3)“地康法”制氯气的反应原理图示如下:
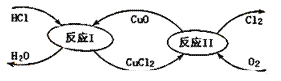
①反应I的化学方程式为_____。
②若要制得标准状况下氯气11.2L,则整个反应中转移电子的物质的量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
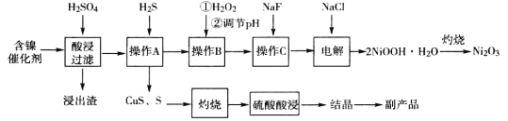
【题目】(加试题)三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,常用于制作重要的电子元件材料和蓄电池材料。某实验室尝试用工业废弃的NiO催化剂(还含有Fe2O3、CaO、CuO、BaO等杂质)为原料生产2NiOOHH2O沉淀,继而制备Ni2O3。实验工艺流程为:
已知:①有关氢氧化物开始沉淀和沉淀完全的pH如表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.6 | 9.7 | 9.2 |
②常温下CaF2难溶于水,微溶于无机酸
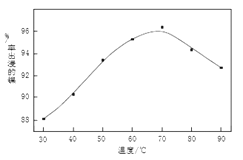
(1)操作B中需调节pH范围为____,使用Na2CO3调节pH过程中发生的反应有___。实验人员发现温度不同时,镍的浸出率不同,浸出率与温度的关系如图所示。请解释当温度高于70℃时,浸出液中Ni2+含量降低的原因____。
(2)下列说法正确的是____
A.为提高酸浸效率,可充分搅拌或适当提高硫酸浓度
B.操作A中应持续通入过量H2S气体使杂质Cu2+彻底沉淀
C.浸出渣的主要成分为CaSO42H2O和BaSO4
D.为得到副产品胆矾,应蒸发浓缩至出现大量晶体,用玻璃纤维代替滤纸进行趁热过滤
(3)电解过程中,Cl-在阳极被氧化为ClO-,但是反应前后溶液中Cl-浓度不变。写出生成沉淀反应的离子方程式_____。
(4)操作C加入NaF后如何证明沉淀完全____。
(5)工业上也可通过将草酸镍(NiC2O42H2O)在热空气中干燥脱水,再在高温下煅烧三小时制得Ni2O3,同时获得混合气体。草酸镍受热分解的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如图,下列叙述不正确的是( )

A. 有机物A属于芳香族化合物
B. 有机物A和NaOH的醇溶液共热可发生消去反应
C. 有机物A和浓硫酸混合加热,可以发生消去反应
D. 1molA和足量的NaOH溶液反应,最多可以消耗 3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】免儿草醛是一种常见的香料添加剂。由免儿草醇制备免儿草醛的反应如下:
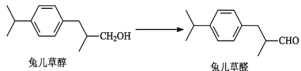
下列说法正确的是( )
A. 兔儿草醛的分子结构中苯环上的二溴代物有4种
B. 兔儿草醇和兔儿草醛都能发生氧化反应、加成反应,不能发生取代反应
C. 将兔儿草醇转化为兔儿草醛所采用的试剂可以是“酸性K2Cr2O7溶液
D. 兔儿草醇分子结构中的所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4═2ClO2↑+K2SO4+2CO2↑+2H2O,试回答下列问题。
(1)该反应中还原剂的化学式是__________;被还原元素的元素符号是_________;
(2)试比较KClO3和CO2的氧化性强弱____________________________________;
(3)消毒时,ClO2还可以将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物,此过程说明ClO2具有___________ (填“氧化”或“还原”)性;
(4)当转移0.2mol电子时,生成的ClO2在标准状况下的体积为_________________________ ;
(5)有下列6种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3组成一个氧化还原反应,将这6种物质分别填入下面对应的横线上,并将该化学方程式配平。
________+________Na2SO3+________→________ +________ +________+_____H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 标况下,224 L H2O含有的分子数为10NA
B. 1 mol任何气体所含的原子数均为NA
C. 28 g CO所含的分子数为NA
D. 标况下,NA个分子的体积为22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com