



| 1 | 18 |
 ;故答案为:
;故答案为: ;
;| 3.2mol |
| 4mol |
| 1 |
| 18 |
| 5 |
| 4 |
| 6 |
| 4 |
| 5 |
| 4 |
| 6 |
| 4 |
| 1 |
| 18 |
| 5 |
| 4 |
| 6 |
| 4 |
| 1 |
| 18 |
| ||
| 2min |
| (4-2)mol |
| 2L |


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
 在如图所示的转化关系中,A、B、C是中学化学中常见的物质,都含有同一种元素R,且所含元素质子数均不超过18.回答下列问题.(说明:图中不含R的产物均已略去,反应②的产物之一是A)
在如图所示的转化关系中,A、B、C是中学化学中常见的物质,都含有同一种元素R,且所含元素质子数均不超过18.回答下列问题.(说明:图中不含R的产物均已略去,反应②的产物之一是A)查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)如图所示的转化关系中,已知A是由短周期元素组成的酸式盐。D.Y.H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
请回答下列问题:
(1)用电子式表示X的形成过程:____________________。
(2)写出D.H.X反应生成A的离子反应方程式:____________________。
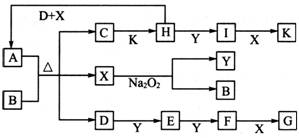
(3)已知:2H(g)+Y(g)![]() 2I(g);
2I(g);![]() 。当加入4 mol H和2 mol Y后,放出345 kJ的热量时,H的转化率最接近于__________(填字母)。
。当加入4 mol H和2 mol Y后,放出345 kJ的热量时,H的转化率最接近于__________(填字母)。
A.40% B.50% C.80% D.90%
(4)标准状况下在1000mL某密闭容器中装有440mL的C溶液,向其中加入3.9g Na2O2充分反应后恢复至原温度,发现容器内气体压强变为原来的1.5倍(忽略溶液体积变化),则原C溶液的物质的量浓度为__________mo1·L-1。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源:2010年湖北省黄冈中学高三5月第二次模拟考试(理科综合)化学部分 题型:填空题
(10分)如图所示的转化关系中,已知A是由短周期元素组成的酸式盐。D.Y.H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。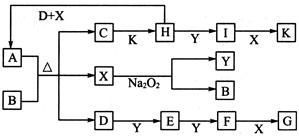
请回答下列问题:
(1)用电子式表示X的形成过程:____________________。
(2)写出D.H.X反应生成A的离子反应方程式:____________________。
(3)已知:2H(g)+Y(g) 2I(g);
2I(g);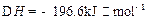 。当加入4 mol H和2 mol Y后,放出345 kJ的热量时,H的转化率最接近于__________(填字母)。
。当加入4 mol H和2 mol Y后,放出345 kJ的热量时,H的转化率最接近于__________(填字母)。
A.40% B.50% C.80% D.90%
(4)标准状况下在1000mL某密闭容器中装有440mL的C溶液,向其中加入3.9g Na2O2充分反应后恢复至原温度,发现容器内气体压强变为原来的1.5倍(忽略溶液体积变化),则原C溶液的物质的量浓度为__________mo1·L-1。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源:2010年湖北省高三5月第二次模拟考试(理科综合)化学部分 题型:填空题
(10分)如图所示的转化关系中,已知A是由短周期元素组成的酸式盐。D.Y.H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
请回答下列问题:
(1)用电子式表示X的形成过程:____________________。
(2)写出D.H.X反应生成A的离子反应方程式:____________________。
(3)已知:2H(g)+Y(g) 2I(g);
2I(g);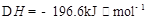 。当加入4 mol H和2 mol Y后,放出345 kJ的热量时,H的转化率最接近于__________(填字母)。
。当加入4 mol H和2 mol Y后,放出345 kJ的热量时,H的转化率最接近于__________(填字母)。
A.40% B.50% C.80% D.90%
(4)标准状况下在1000mL某密闭容器中装有440mL的C溶液,向其中加入3.9g Na2O2充分反应后恢复至原温度,发现容器内气体压强变为原来的1.5倍(忽略溶液体积变化),则原C溶液的物质的量浓度为__________mo1·L-1。(保留两位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com