
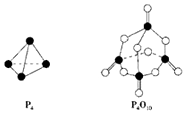
 白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P═O c kJ•mol-1、O═O d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )| A. | (6a+5d-4c-12b) kJ•mol-1 | B. | (4c+12b-6a-5d) kJ•mol-1 | ||
| C. | (4c+12b-4a-5d) kJ•mol-1 | D. | (4c+5d-4a-12b) kJ•mol-1 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
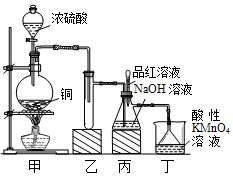 某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如图所示:
某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如图所示:| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液.静置一段时间后,得到滤液A和固体B. | |
| 步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再滴加盐酸. | 若品红褪色(或有气泡),则说明含有Na2SO3. |
| 步骤3:用试管取少量A,向其中加入过量的氢氧化钡溶液或先加入品红再加入盐酸. | 若若生成白色沉淀或品红褪色,则说明有NaHSO3生成; 否则不存在NaHSO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3易液化,氨常用作制冷剂 | |
| B. | 胆矾遇浓硫酸变白是因为浓硫酸的脱水性 | |
| C. | 氨催化氧化制硝酸过程中的三个主要反应都属于氧化还原反应 | |
| D. | 浓硝酸需保存在棕色瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 炭粉中加入浓硝酸并加热,导出的气体通入少量澄清石灰水中 | 有红棕色气体产生,石灰水变浑浊 | 有NO2和CO2产生 |
| B | FeCl3和BaCl2混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | 沉淀为BaSO3 |
| C | 钠块放在石棉网上加热 | 钠块熔化,最终得淡黄色固体 | 熔点:Na2O2>Na |
| D | 蔗糖中滴入浓硫酸并不断搅拌 | 产生黑色蓬松多孔固体 | 浓硫酸具有吸水性和强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5L 2mol/L盐酸中含有NA氯化氢分子 | |
| B. | 在标准状况下,2.24L氖气含有NA个电子 | |
| C. | 常温下,24gC2H518OH分子中含有3.5NA个共价键 | |
| D. | 若2H2S+O2═2S+2H2O生成3.2g硫,则反应过程中转移0.1NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com