
| A. | ①②④ | B. | ①③⑤ | C. | ②③⑤ | D. | 只有③ |
分析 ①非金属在反应中能作氧化剂,也可能作还原剂;
②氧化剂得电子发生还原反应;
③还原剂被氧化;
④溶液中的离子反应也可能存在化合价的变化;
⑤溶液中离子浓度增大,导电性增强.
解答 解:①金属在反应中只能失电子,只能作还原剂,非金属在反应中能作氧化剂,也可能作还原剂,如硫在空气中燃烧,硫作还原剂,故错误;
②氧化剂得电子,化合价降低,发生还原反应,故错误;
③氧化还原反应中失电子的物质反应是还原剂,所以还原剂化合价升高失电子,被氧化,故正确;
④溶液中的离子反应也可能存在化合价的变化,如铁离子与Cu反应生成亚铁离子和铜离子,是离子反应也是氧化还原反应,故错误;
⑤溶液中离子浓度增大,导电性增强,如醋酸溶液中加少量的氢氧化钠固体,溶液中离子浓度增大,导电性增强,故错误.
故选D.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化和离子反应的特点为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
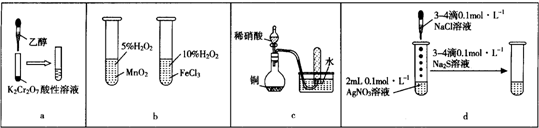
| A. | a图示装置,滴加乙醇试管中橙色溶液变为绿色,乙醇发生消去反应生成乙酸 | |
| B. | b图示装置,右边试管中产生气泡迅速,说明氯化铁的催化效果比二氧化锰好 | |
| C. | c图示装置,根据试管中收集到无色气体,验证铜与稀硝酸的反应产物是NO | |
| D. | d图示装置,试管中先有白色沉淀、后有黑色沉淀,不能验证AgCl的溶解度大于Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2A溶液中一定有:c(OH-)=c(H+)+c(HA-) | |
| B. | Na2A溶液呈碱性,NaHA溶液可能酸性可能呈碱性 | |
| C. | Na2A溶液中一定有c(Na+)+c(H+)=c(OH-)+c(A2-)+c(HA-) | |
| D. | NaHA溶液一定有c(Na+)>c(HA)>c(OH-)>c(H2A)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | 平衡向正反应方向移动 | ||
| C. | A的体积分数下降 | D. | B的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样,滴加AgNO3溶液,看是否有白色沉淀 | |
| B. | 取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| C. | 取样,加少量AgNO3溶液,有白色沉淀,再加稀HCl,看白色沉淀是否消失 | |
| D. | 取样,加少量AgNO3溶液,有白色沉淀,再加稀HNO3,看白色沉淀是否消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
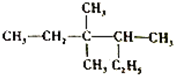
| A. | 2-乙基-3,3-二甲基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 3,3-甲基-4乙基戊烷 | D. | 2,3,3-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
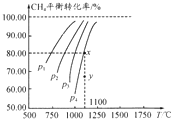 在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )
在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )| A. | 上述反应的△H<0 | |
| B. | 压强P1>P2>P3>P4 | |
| C. | 1100℃时该反应的平衡常数约为1.64 | |
| D. | 压强为P4时,y点的v正<v逆 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com