
| 编号 | 实验内容 | 实验目的 |
| A | 取两只试管,分别加入4ml 0.01mol/L KMnO4酸性溶液,然后向一只试管中加入0.1mol/L H2C2O4溶液2ml,向另一只试管中加入0.1mol/L H2C2O4溶液4ml,记录褪色时间。 | 可以证明H2C2O4浓度越大反应速率越快。 |
| B | 向1ml 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀。 | 可以证明在相同温度下,溶解度Mg(OH)2>Fe(OH)3 |
| C | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大。 | 证明了非金属性S>C |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色会变浅。 | 可以证明Na2CO3溶液中存在水解平衡。 |


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源:不详 题型:填空题
 [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡正向移动 NH3·H2O+H+达到平衡后,升高温度平衡正向移动 |
| B.在硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,该现象不足以说明Ksp(BaSO4)与Ksp(BaCO3)大小关系。 |
| C.明矾水解生成Al(OH)3胶体,可用作净水剂 |
| D.如图所示的反应过程中A+B→X的△H<0,X→C的△H>0 |
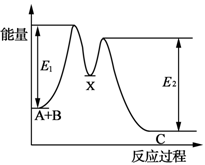
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在氧化还原反应中,一种元素被氧化的同时一定有另一种元素被还原 |
| B.在原电池装置中,一定要有两个活泼性不同的金属作为电极材料 |
| C.在化合物中,不是电解质就是非电解质 |
| D.对于可逆反应,温度升高则该反应的平衡常数一定增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在潮湿的空气中,马口铁和白铁皮镀层受损后,铁都比受损前更容易生锈 |
| B.CaCO3(s)=CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的ΔH<0 |
C.反应N2(g)+3H2(g) 2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大 2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值均大于零): |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CH(g)+H2(g) △H1="156.6" kJ/mol
CH(g)+H2(g) △H1="156.6" kJ/mol
 CH2(g)=CH4(g)+HC
CH2(g)=CH4(g)+HC
 CH(g ) △H2="32.4" kJ/mol
CH(g ) △H2="32.4" kJ/mol CH2(g)+H2(g)的△H= kJ/mol。
CH2(g)+H2(g)的△H= kJ/mol。 HCO3-+H+的平衡常数K1= 。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= 。(已知10-5.60=2.5×10-6)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (K) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |

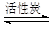 SO2Cl2(l) △H=–97.3kJ·mol—1
SO2Cl2(l) △H=–97.3kJ·mol—1查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
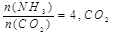 的转化率随时间的变化关系如图1所示。
的转化率随时间的变化关系如图1所示。 点速率为V正(CO2)(填“大于”、“小于”或“等于”)
点速率为V正(CO2)(填“大于”、“小于”或“等于”)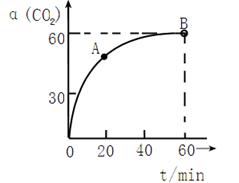
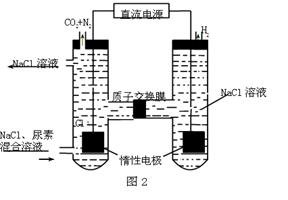
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com