
【题目】邻苯二甲酸二丁酯DBP是一种常见的塑化剂,可以乙烯和邻二甲苯为原料合成,合成过程如图所示:
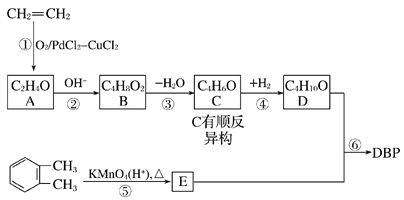
请回答下列问题:
(1)DBP的分子式为________________,C的顺式结构为________________。
(2)B中含有的官能团名称为________________,反应③的类型为________反应。
(3)写出下列反应的化学方程式
反应③______________________________________________________________
反应⑥_______________________________________________________________
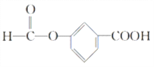
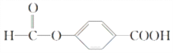
(4)E的一种同分异构体F,,苯环上含有两个取代基,能与NaOH溶液反应,且1 mol F完全反应消耗3 mol NaOH,写出F所有可能的结构简式:_______________________________________________________________。
(5)检验C中碳碳双键的方法_______________________________________。
【答案】 C16H22O4 ![]() 羟基、醛基 消去
羟基、醛基 消去 ![]()
![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O ![]() +2CH3CH2CH2CH2OH
+2CH3CH2CH2CH2OH![]()
![]() +2H2O
+2H2O  、
、 、
、 取少量C于试管中,加入足量银氨溶液[或新制的Cu(OH)2悬浊液]水浴加热,再加入酸性高锰酸钾溶液(或溴水),若酸性高锰酸钾溶液(或溴水)褪色,则证明含有碳碳双键。
取少量C于试管中,加入足量银氨溶液[或新制的Cu(OH)2悬浊液]水浴加热,再加入酸性高锰酸钾溶液(或溴水),若酸性高锰酸钾溶液(或溴水)褪色,则证明含有碳碳双键。
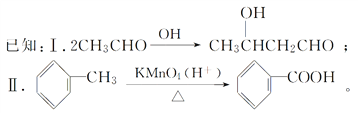
【解析】A分子式是C2H4O,A发生信息中醛的加成反应生成B,则A是乙醛,结构简式为CH3CHO,B为![]() ,所以乙烯发生氧化反应生成乙醛;B脱去1分子水生成C,根据B分子式为C4H8O2,C分子式为C4H6O,可知B→C发生消去反应;因为C有顺反异构,所以C的结构简式为CH3CH=CHCHO;C与氢气发生加成反应生成D,根据C与D的分子式可知,碳碳双键、羟基均发生了加成反应,故D结构简式为CH3CH2CH2CH2OH;由已知Ⅱ可得,
,所以乙烯发生氧化反应生成乙醛;B脱去1分子水生成C,根据B分子式为C4H8O2,C分子式为C4H6O,可知B→C发生消去反应;因为C有顺反异构,所以C的结构简式为CH3CH=CHCHO;C与氢气发生加成反应生成D,根据C与D的分子式可知,碳碳双键、羟基均发生了加成反应,故D结构简式为CH3CH2CH2CH2OH;由已知Ⅱ可得,![]() 发生氧化反应生成E为
发生氧化反应生成E为![]() ,E与D(CH3CH2CH2CH2OH)发生酯化反应生成DBP为
,E与D(CH3CH2CH2CH2OH)发生酯化反应生成DBP为![]() 。
。
(1)由DBP的结构简式可得,分子中含C原子数为16、H原子数为22、O原子数为4,故分子式为C16H22O4;C有顺反异构,其顺式结构为:![]() 。
。
(2)B为![]() ,含有羟基和醛基两种官能团;由前面的分析知反应③(即B→C)发生消去反应。
,含有羟基和醛基两种官能团;由前面的分析知反应③(即B→C)发生消去反应。
(3)反应③为B(![]() )消去生成C(CH3CH=CHCHO),反应条件可以为NaOH的乙醇溶液,故反应的化学方程式为:
)消去生成C(CH3CH=CHCHO),反应条件可以为NaOH的乙醇溶液,故反应的化学方程式为:![]()
![]() CH3CH=CHCHO+H2O;反应⑥是D(CH3CH2CH2CH2OH)与E(
CH3CH=CHCHO+H2O;反应⑥是D(CH3CH2CH2CH2OH)与E(![]() )发生酯化反应,故反应的化学方程式为:
)发生酯化反应,故反应的化学方程式为:![]() +2CH3CH2CH2CH2OH
+2CH3CH2CH2CH2OH![]()
![]() +2H2O。
+2H2O。
(4)E为![]() ,E的一种同分异构体F,苯环上含有两个取代基,能与NaOH溶液反应,则F中可能含有羧基或酯基,又因为1molF完全反应消耗3molNaOH,所以分子中应含有一个羧基和一个酯基,则F可能的结构简式为:
,E的一种同分异构体F,苯环上含有两个取代基,能与NaOH溶液反应,则F中可能含有羧基或酯基,又因为1molF完全反应消耗3molNaOH,所以分子中应含有一个羧基和一个酯基,则F可能的结构简式为: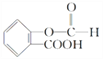 、
、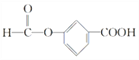 、
、![]() 。
。
(5)C的结构简式为CH3CH=CHCHO,分子中含有碳碳双键和醛基,醛基能与酸性高锰酸钾溶液(或溴水)反应,对碳碳双键的检验造成干扰,所以先加银氨溶液[或新制的Cu(OH)2悬浊液]水浴加热氧化-CHO后,(调节pH至酸性)再加入酸性高锰酸钾溶液(或溴水),看是否褪色。


科目:高中化学 来源: 题型:
【题目】一种盐X与烧碱混合共热,可放出无色气体Y,Y经一系列氧化后再溶于水可得Z溶液,Y和Z反应又生成X,则X是( )
A.(NH4)2SO4B.NH4NO3
C.NH4ClD.NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,△H1=﹣393.5kJmol﹣1 , △H2=﹣395.4kJmol﹣1 , 下列说法正确的是( ) 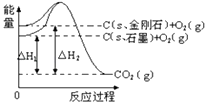
A.金刚石的稳定性强于石墨
B.12g石墨总键能比12g金刚石小1.9kJ
C.石墨和金刚石的转化是物理变化
D.C(s、石墨)=C(s、金刚石)△H=+1.9 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
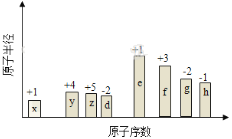
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
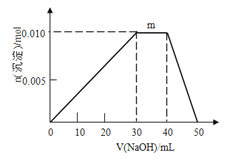
①写出m点反应的离子方程式_____________________________。
②若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】250mL K2SO4和CuSO4的混合溶液中c(SO ![]() )=0.5molL﹣1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下).假定电解后溶液体积仍为250mL,下列说法不正确的是( )
)=0.5molL﹣1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12 L气体(标准状况下).假定电解后溶液体积仍为250mL,下列说法不正确的是( )
A.电解得到Cu的质量为3.2 g
B.上述电解过程中共转移电子0.2 mol
C.电解后的溶液中c(H+)=0.2 molL﹣1
D.原混合溶液中c(K+)=0.6 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列元素的原子半径:根据以上数据,磷原子的半径(10-10m)可能是( )
元素 | N | S | O | Si |
原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
A.0.80B.1.15C.1.19D.0.70
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存.
(1)一定温度下,向1L 0.1molL﹣1CH3COOH溶液中加入0.1mol CH3COONa固体,溶液中 ![]() (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 .
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 .
(2)常温下向20mL 0.1molL﹣1Na2CO3溶液中逐滴加入0.1molL﹣1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:回答下列问题: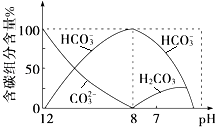
①在同一溶液中,H2CO3、HCO ![]() 、CO
、CO ![]() (填“能”或“不能”)大量共存;
(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有、 , 溶液中含量最多的三种微粒的物质的量浓度的大小关系为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.4 g Al 投入到200.0 mL 2.0 mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为
A. HNO3溶液 B. Ba(OH)2溶液 C. H2SO4溶液 D. HCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com