(2012?浙江模拟)大气中SO
2和NO
x是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na
+、Mg
2+、NH
4+、Cl
-、SO
32-、SO
42-、NO
3-和NO
2-等.某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl
2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入足量硝酸酸化的AgNO
3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO
4溶液,不褪色.
已知:K
sp(Ag
2SO
4)=1.20×10
-5请回答下列问题:
(1)该酸雨中肯定存在的离子有
SO42-、NO3-、NH4+
SO42-、NO3-、NH4+
;肯定不存在的离子有
SO32-、NO2-
SO32-、NO2-
,说明其不存在的理由:
SO32-具有较强的还原性,酸性条件下,与NO3-不能共存;若有NO2-,能使酸性KMnO4
溶液褪色
SO32-具有较强的还原性,酸性条件下,与NO3-不能共存;若有NO2-,能使酸性KMnO4
溶液褪色
.
(2)写出试液中滴加淀粉KI溶液所发生反应的离子方程式:
6I-+2NO3-+8H+=3I2+2NO↑+4H2O
6I-+2NO3-+8H+=3I2+2NO↑+4H2O
.
(3)设计实验方案,检验该试液中是否存在Cl
-:
取少量试液,滴加足量的Ba(NO3)2溶液,静置;取上层清液,滴加硝酸酸化的AgNO3
溶液,若有白色沉淀产生,则存在Cl-
取少量试液,滴加足量的Ba(NO3)2溶液,静置;取上层清液,滴加硝酸酸化的AgNO3
溶液,若有白色沉淀产生,则存在Cl-
.
(4)该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO
2气体,慢慢通入O
2,该过程中发生的化学反应有
2NO+O2=2NO2
2NO+O2=2NO2
、
NO2+SO2=SO3+NO
NO2+SO2=SO3+NO
,再喷射适量蒸馏水即得硫酸型酸雨.说明NO的作用:
催化剂
催化剂
.



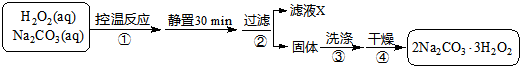
 已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)
已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)  2Na2CO3?3H2O2 (s)
2Na2CO3?3H2O2 (s)