
 |  |  |  |
| ① | ② | ③ | ④ |
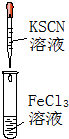
| A. | 实验①试管中混合溶液中出现红色沉淀 | |
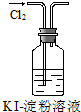
| B. | 实验②中溶液变黄色 | |
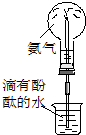
| C. | 实验③中烧瓶内溶液变红色 | |
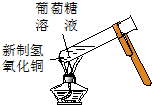
| D. | 实验④中出现黑色氧化铜固体 |
分析 A.铁离子与KSCN结合生成络离子;
B.氯气与KI反应生成碘单质;
C.氨气极易溶于水,且溶液显碱性;
D.葡萄糖中含-CHO,与新制氢氧化铜反应生成氧化亚铜.
解答 解:A.铁离子与KSCN结合生成络离子,则观察到溶液变为血红色,故A错误;
B.氯气与KI反应生成碘单质,淀粉遇碘单质变蓝,则观察到溶液变为蓝色,故B错误;
C.氨气极易溶于水,且溶液显碱性,则可观察到红色喷泉,故C正确;
D.葡萄糖中含-CHO,与新制氢氧化铜反应生成氧化亚铜,则可观察到砖红色沉淀,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握常见物质的性质及离子检验为解答的关键,注意方案的评价性和操作性分析,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,28 g N2含有的分子数为2NA | |
| B. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| C. | 标准状况下,1mol CCl4的体积约为22.4 L | |
| D. | 2.3g的金属钠变为钠离子时失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3在水溶液中水解:HCO3-+H2O?H3O++CO32- | |
| B. | 电解饱和食盐水:C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+Cl2↑+OH- | |
| C. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH- | |
| D. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有盐酸的洁厕剂和含有次氯酸钠的消毒液混用可以增强洗涤和消毒的效果 | |
| B. | 过量的Fe和Cu在等物质的量的Cl2中燃烧,转移的电子数相等 | |
| C. | 等体积、等浓度的NH4Cl溶液和稀氨水中,所含NH4+的数目相等 | |
| D. | 等物质的量的过氧化钡(BaO2)和Ba(OH)2固体中,阴阳离子个数比均为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3中的氯元素被氧化 | |
| B. | Cl2既是氧化剂,又是还原剂 | |
| C. | 还原剂是HCl | |
| D. | 每生成1mol Cl2转移电子的物质的量为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
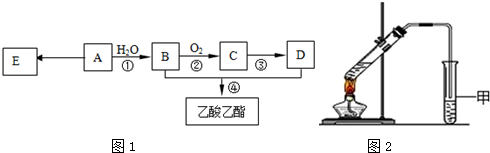
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,则消耗Na、NaOH、NaHCO3的物质的量之比为( )
Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,则消耗Na、NaOH、NaHCO3的物质的量之比为( )| A. | 3:3:3 | B. | 3:2:2 | C. | 3:2:1 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 4.7 |
| 完成沉淀pH | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
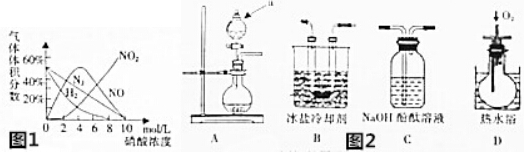
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com