
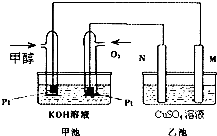
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池.如图中甲池是一个甲醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol.L-1的CuSO4溶液.已知H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ?g-1、10kJ?g-1和23kJ?g-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池.如图中甲池是一个甲醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol.L-1的CuSO4溶液.已知H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ?g-1、10kJ?g-1和23kJ?g-1.请回答下列问题:| 1 |
| 2 |
| 1 |
| 2 |
| 1-a+3-3a+a+a |
| 1+3 |
| 2-a |
| 2 |
| 2-a |
| 2 |


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
| A、使用容量瓶前检查它是否漏水 |
| B、容量瓶用蒸馏水洗净后,再用待配溶液润洗 |
| C、配制1mol/LNaOH溶液时,NaOH在烧杯中溶解后立即转入容量瓶 |
| D、配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线2~3cm处,用滴管滴加蒸馏水到刻度线 |
| E、盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质失去电子数越多,物质的还原性越强 |
| B、导电的不一定是电解质,电解质不一定导电 |
| C、得到电子的物质是还原剂 |
| D、还原剂反应后得到是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
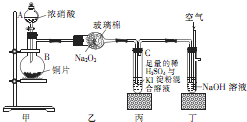 某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题
某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题| 装置编号 | 实验现象 | 反应的化学方程式 | NO2表现的化学性质 |
| 乙 | 淡黄色固体变白色 | Na2O2+2NO2═2NaNO3 | |
| 丙 | 氧化性 |
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测溶液于试管A中,加入几滴 |
|
| 步骤② | |
|
| 步骤③ | 另取少量待测溶液于试管C中,加入足量氯水,再加入四氯化碳,静置后观察颜色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应 | A | B | C | D |
| △H/kJ?mol-1 | 10.5 | 1.80 | -126 | -11.7 |
| △S/J?mol-1?K-1 | 30.0 | -113.0 | 84.0 | -105.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 水果种类 | 电极间距离/cm | 电流大小/?A |
| ① | 西红柿 | 1 | 98.7 |
| ② | 西红柿 | 2 | 72.5 |
| ③ | 苹 果 | 2 | 27.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
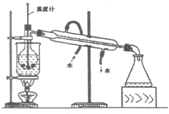 实验室里化学兴趣小组的探究活动是:从海带中提取碘,他们先将海带灼烧成灰,加入热水并搅拌成浊液(含I-),接下来的流程如下:(每一步反应均充分)
实验室里化学兴趣小组的探究活动是:从海带中提取碘,他们先将海带灼烧成灰,加入热水并搅拌成浊液(含I-),接下来的流程如下:(每一步反应均充分)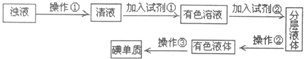
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com