
【题目】设NA表示阿伏加德罗常数的数值,下列叙述正确的是
①标况下2.24L己烷中,含1.4NA个C-H键
②常温常压下,16gO2和O3混合气体中,电子数为8NA
③过氧化钠与水反应,产生3.2g氧气,则电子转移数目为0.2NA
④0.1mol/LKAl(SO4)2溶液中含Al3+数目小于0.1NA
⑤将0.1molFeCl3配成氢氧化铁胶体,胶体粒子数目最多可达到0.1NA
⑥将2.8gN2与足量氢气充分反应,得到氨气分子数目少于0.2NA
A. ①②④⑥ B. ③④⑤⑥
C. ②③⑥ D. ②③④
【答案】C
【解析】①标准状况下,己烷不是气体,2.24L己烷物质的量不是0.1mol,故①错误;②16gO2和O3混合气体含O物质的量为1mol,故电子数为8NA,②正确;③过氧化钠与水反应为Na2O2中氧元素的歧化反应, ,生成1molO2转移2mol电子,所以生成3.2g氧气(0.1mol),则电子转移数目为0.2NA,故③正确;④溶液体积未知,无法计算Al3+数目,故④错误;⑤胶体粒子是Fe(OH)3微粒的集合体,故0.1molFeCl3最多生成0.1NA个Fe(OH)3微粒,胶体粒子数目小于0.1NA,⑤错误;⑥若2.8gN2(0.1mol)完全反应,则得到氨气分子数目等于0.2NA,因为该反应为可逆反应,故得到氨气分子数目少于0.2NA,⑥正确。综上,②③⑥正确,选C。
,生成1molO2转移2mol电子,所以生成3.2g氧气(0.1mol),则电子转移数目为0.2NA,故③正确;④溶液体积未知,无法计算Al3+数目,故④错误;⑤胶体粒子是Fe(OH)3微粒的集合体,故0.1molFeCl3最多生成0.1NA个Fe(OH)3微粒,胶体粒子数目小于0.1NA,⑤错误;⑥若2.8gN2(0.1mol)完全反应,则得到氨气分子数目等于0.2NA,因为该反应为可逆反应,故得到氨气分子数目少于0.2NA,⑥正确。综上,②③⑥正确,选C。


科目:高中化学 来源: 题型:
【题目】如图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g)![]() xC(g)的生成物 C在反应混合物中的体积分数和反应时间的关系。
xC(g)的生成物 C在反应混合物中的体积分数和反应时间的关系。

(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则 曲线表示无催化剂时的情况,反应速率:a b(填“大于”“小于”或“等于”)。
(2)若乙图表示反应达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入氦气后的情况,则 曲线表示恒温恒容的情况,在恒温恒容条件下,C的体积分数 (填“变大”“变小”或“不变”)。
(3)根据丙图可以判断该可逆反应的正反应是 (填“放热”或“吸热”)反应,化学计量数x的值(或取值范围)是 。
(4)丁图表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度(T)的变化情况,根据你的理解,丁图的纵轴可以是 [填:①φ(C)/% ②A的转化率 ③B的转化率 ④压强 ⑤c(A) ⑥c(B)];升温平衡移动的方向为 (填“左移”或“右移”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立足教材实验是掌握高中化学实验的基础,是理解化学科学的实验原理、实验方法和实验思路,提高学生实验能力的基本途径:
(1)实验1:取一块金属钠,在玻璃片上用滤纸吸干表面的煤油后,用小刀切去一端的外皮,观察钠的颜色,这个实验中还需用到的一种仪器是_________;
(2)实验2:向一个盛有水的小烧杯里滴入几滴酚酞试液,然后把一小块钠投入小烧杯,把反应的现象和相应结论填入空格,“浮”--钠的密度比水小;“红”--反应生成了氢氧化钠;“熔”——______________;
(3)实验3:用坩埚钳夹住一小块用砂纸仔细打磨过的铝,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释正确的是_________
A.火焰温度太低不能使铝燃烧 B.铝在空气中能很快形成氧化膜
C.氧化铝的熔点比倡的熔点高 D.打磨砂纸不能除去表面的氧化膜
(4)实验4:把少量水滴入盛有Na2O2固体的试管中,立即用带火星的木条放在试管口,检验
生成的气体体,向反应后的溶液中加入酚酞试液,可以看到__________;
(5)实验5:在玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,该氧化还原反应的氧化剂是__________,该反应每消耗1mol铁,转移电子的物质的量为_________。
(6)实验6:在试管中注入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管尖端插入试管里溶液底部,慢慢挤出NaOH溶液,可以看到开始时析出一种白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色,发生这种颜也变化的原因是(用化学方程式表示):______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g) ΔH,随温度升高,混合气体的颜色变深。
2NO2(g) ΔH,随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的ΔH__________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,平均反应速率v(NO2)为__________molL-1s-1,反应的平衡常数K为____________________________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4) 以0.0020 molL-1s-1的平均速率降低,经10 s又达到平衡。则T__________100℃(填“大于”或“小于”)。
(3)利用图(a)和(b)中的信息,按图(b)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_____________________________。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜粉放入稀硫酸溶液中,加热后无明显变化,但加入某盐一段时间后,发现铜粉溶解,溶液呈蓝色,且无气体逸出,该盐可能是
A. FeC13 B. Na2CO3 C. KNO3 D. FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
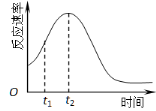 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

① ;② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是___(填序号),配制上述溶液还需用到的玻璃仪器是____________(填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有______(填序号)。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体 D.准确稀释某一浓度的溶液
E.量取一定体积的液体 F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度______0.1 mol·L-1(填“大于”“等于”或“小于”,下同)。
(4)根据计算可知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和浓盐酸之间有下列反应:2KClO3 + 4HCl(浓)== 2 KCl + Cl2↑+ 2ClO2 + 2H2O。
(1)该反应中发生还原反应的物质是__________。氧化产物是___________。
(2)用双线桥标出方程式中的电子得失___________。
2KClO3 + 4HCl(浓)== 2 KCl + Cl2↑+ 2ClO2 + 2H2O
(3)当有0.2mol电子发生转移时,生成的氯气的体积为_____L(标准状况)。被氧化的HCl的物质的量为____mol。
(4)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+)③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 碳酸钙跟醋酸反应:CaCO3+2H+===Ca2++CO2↑+H2O
B. 金属钠加入到CuSO4溶液中:2Na+Cu2+===Cu+2Na+
C. 铁跟稀盐酸反应:Fe+2H+===Fe2++H2↑
D. 碳酸氢钙溶液跟足量烧碱溶液反应:Ca2++HCO![]() +OH-===CaCO3↓+H2O
+OH-===CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com