
在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
A.稀释溶液,水解平衡常数增大 B.通入CO2,平衡向正反应方向移动
C.升高温度,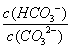 减小 D.加入NaOH固体,溶液pH减小
减小 D.加入NaOH固体,溶液pH减小
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
氰氨基化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN = CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
A.CO为氧化产物,H2为还原产物 B.CaCN2中含有非极性键
C.HCN既是氧化剂又是还原剂 D.每消耗10g CaCO3生成2.24L CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列反应热数据,有关分析或说法不正确的是

A.上述四种有机物中环已烷最稳定
B.苯分子中不存在独立的碳碳双键
C.1,3—环已二烯比苯稳定
D.苯与H2反应生成1,3—环已二烯吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下的反应N2(g)+ 3 H2(g) 2NH3(g) △H<0达到平衡,下列变化既能加快反应速率又能使平衡向正反应方向移动的是
2NH3(g) △H<0达到平衡,下列变化既能加快反应速率又能使平衡向正反应方向移动的是
A.升温 B.减压 C.加压 D.加催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.将水加热,Kw增大,pH不变
B.燃烧热是指可燃物热化学反应方程式中的△H
C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液
D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2(g) N2O4 (g) △H < 0,若把烧瓶置于100℃ 的沸水中,下列情况中不变的是
N2O4 (g) △H < 0,若把烧瓶置于100℃ 的沸水中,下列情况中不变的是
A.气体的物质的量 B.压强 C.质量 D.密度
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产SO3的反应为:2SO2(g)+ O2(g) 2SO3(g) ,若在一定温度下,将0.1mol
2SO3(g) ,若在一定温度下,将0.1mol
的SO2(g)和0.06mol O2(g)注入一体积为2L的密闭容器中,10min达到平衡状态,此时测
得容器中有0.08mol的SO3(g)。试求在该温度下:
(1)SO2(g)的平衡转化率。 (2)此反应的平衡常数。 (要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1、-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为 5.52×103kJ 。
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(4)COCl2的分解反应为COCl2(g)===Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):

①计算反应在第8 min时的平衡常数K= 0.234 mol·L-1 ;
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2) < T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= 0.031 mol·L-1;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小 v(2~3)>v(5~6)=v(12~13) ;
⑤比较反应物COCl2在5~6 min和15~16 min时平均反应速率的大小v(5~6) > v(12~13)(填“<”、“>”或“=”),原因是 在相同温度时,该反应的反应物浓度越高,反应速率越大 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将8 g Fe2O3投入150 mL某浓度的稀硫酸中,再投入7 g铁粉收集到1.68 L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol/L的NaOH溶液150 mL。则原硫酸的物质的量浓度为( )
A.1.5 mol/L B.0.5 mol/L
C.2 mol/L D.1.2 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com