
| A. | H2 | B. | CH2O2 | C. | C6H12O6 | D. | C12H22O11 |
分析 水、二氧化碳和Na2O2反应方程式分别为2H2O+2Na2O2=4NaOH+O2、2Na2O2+2CO2=2Na2CO3+O2,根据方程式知,水和Na2O2反应时固体质量增加量相当于H2质量,二氧化碳和Na2O2反应时固体质量增加量相当于CO质量,将可燃物写出H2或CO或(CO)m•Hn方式,如果恰好写为H2或CO或(CO)m•Hn方式,则产物通过足量Na2O2时固体质量不变,如果改写化学式时O原子有剩余,则反应前后固体质量减少,如果C原子有剩余,则固体质量增加,据此分析解答.
解答 解:水、二氧化碳和Na2O2反应方程式分别为2H2O+2Na2O2=4NaOH+O2、2Na2O2+2CO2=2Na2CO3+O2,根据方程式知,水和Na2O2反应时固体质量增加量相当于H2质量,二氧化碳和Na2O2反应时固体质量增加量相当于CO质量,将可燃物写出H2或CO或(CO)m•Hn方式,如果恰好写为H2或CO或(CO)m•Hn方式,则产物通过足量Na2O2时固体质量不变,如果改写化学式时O原子有剩余,则反应前后固体质量减少,如果C原子有剩余,则固体质量增加;
A.通过以上分析知,可燃物是氢气,在反应前后固体质量不变,不符合,故A不选;
B.该化学式可以改写为CO.H2.O,O原子有剩余,所以反应前后固体质量减少,不符合,故B不选;
C.该化学式可以改写为(CO)6•H12,则反应前后固体质量不变,不符合,故C不选;
D.该化学式可以改写为(CO)11•H22.C,则反应前后固体质量增大,符合,故D选;
故选D.
点评 本题考查化学方程式有关计算,明确反应前后固体质量增加成分是解本题关键,利用化学式分析判断即可,注意解题方法技巧,题目难度中等.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题

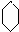
 .反应⑥的化学方程式是
.反应⑥的化学方程式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| C. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| D. | 100mL0.1mol•L-1醋酸溶液含有的分子总数一定小于0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素性质 | 元素编号 | ||||||
| 原子半径(nm) | A | B | C | D | E | F | G |
| 0.073 | 0.075 | 0.037 | 0.110 | 0.099 | 0.186 | 0.143 | |
| 最高正化合价 | 无 | +5 | +1 | +5 | +7 | +1 | +3 |
| 最低负化合价 | -2 | -3 | -1 | -3 | -1 | 无 | 无 |
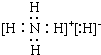 (用电子式表示)
(用电子式表示) .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH2 1,3二丁烯 | B. | 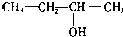 3-丁醇 | ||
| C. | 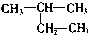 2-甲基丁烷 2-甲基丁烷 | D. |  甲基苯酚 甲基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com