
【题目】(1)已知在标准状况下的四种气体①6.72LCH4②3.01×1023个HCl分子③13.6gH2S④0.2molNH3,密度最大的是 (填序号)。
(2)标准状况下,甲烷和一氧化碳的混合气体共8.96L,其质量为7.6g,则混合气体中甲烷的体积分数为____________。
(3)某物质A加热时按化学方程式2A═2B+C+3D分解,产物均为气体,测得由生成物组成的混合物气体对H2的相对密度为20,则反应物A的摩尔质量为____________。
(4)80 g密度为1 gcm-3的CaCl2溶液里含2 g Ca2+,从中再取出一半的溶液中Cl-的物质的量浓度是 。
(5)10 mL 0.1 mol·L-1 BaCl2溶液恰好使相同体积的硫酸铁、硫酸铜两种溶液中的SO42-完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是 。
【答案】(1)②(2)75%(3)120g/mol(4)1.25mol/L(5)1∶3
【解析】
试题分析:(1)由![]() 可知,同温同压下气体的密度与相对分子质量成正比,气体的相对分子质量越大,密度也就越大,由题意可知,四种气体的相对分子质量分别为16、36.5、34、17,36.5最大,答案选②;(2)先由
可知,同温同压下气体的密度与相对分子质量成正比,气体的相对分子质量越大,密度也就越大,由题意可知,四种气体的相对分子质量分别为16、36.5、34、17,36.5最大,答案选②;(2)先由![]() 可知,n(CH4) + n(CO) =
可知,n(CH4) + n(CO) = ![]() mol = 0.4 mol,再设甲烷为x mol,则CO为(0.4-x) mol,然后由nM可知,16x+28×(0.4-x) = 7.6,解得:x = 0.3,最后由
mol = 0.4 mol,再设甲烷为x mol,则CO为(0.4-x) mol,然后由nM可知,16x+28×(0.4-x) = 7.6,解得:x = 0.3,最后由![]() 计算甲烷的体积分数为
计算甲烷的体积分数为![]() ×100%=75%;(3)先由
×100%=75%;(3)先由![]() 可知,同温同压下两种气体的密度之比等于相对分子质量之比,则
可知,同温同压下两种气体的密度之比等于相对分子质量之比,则![]() ,再由题意可知,
,再由题意可知,![]() ,则混合气体的平均摩尔质量为20 ×2 gmol-1 = 40 gmol-1,然后由2A═2B+C+3D可设参加反应的A为2mol,则生成的混合气体总共有(2+1+3)mol = 6 mol,再由nM可知,生成的混合气体的总质量为6×40 g = 240 g,然后由质量守恒定律可知,反应物的总质量也为240g,最后由
,则混合气体的平均摩尔质量为20 ×2 gmol-1 = 40 gmol-1,然后由2A═2B+C+3D可设参加反应的A为2mol,则生成的混合气体总共有(2+1+3)mol = 6 mol,再由nM可知,生成的混合气体的总质量为6×40 g = 240 g,然后由质量守恒定律可知,反应物的总质量也为240g,最后由![]() 可知,M(A) =
可知,M(A) = ![]() gmol-1 = 120 gmol-1;(4)先根据
gmol-1 = 120 gmol-1;(4)先根据![]() 、
、![]() 分别计算溶液的体积、钙离子的物质的量分别为
分别计算溶液的体积、钙离子的物质的量分别为![]() mL=0.08 L、
mL=0.08 L、![]() mol = 0.05 mol,再由
mol = 0.05 mol,再由![]() 可知,c(Ca2+) =
可知,c(Ca2+) = ![]() mol·L-1 = 0.625 mol·L-1,然后由电离方程式CaCl2=Ca2++2Cl-中两种离子的浓度之比等于系数之比可知,c(Cl-) = 2 c(Ca2+) = 2×0.625 mol·L-1 =1.25 mol·L-1;(5)先由cV计算BaCl2或Ba2+的n为0.001mol,再由离子方程式Ba2++SO42- =
mol·L-1 = 0.625 mol·L-1,然后由电离方程式CaCl2=Ca2++2Cl-中两种离子的浓度之比等于系数之比可知,c(Cl-) = 2 c(Ca2+) = 2×0.625 mol·L-1 =1.25 mol·L-1;(5)先由cV计算BaCl2或Ba2+的n为0.001mol,再由离子方程式Ba2++SO42- = ![]() 可知,Fe2(SO4)3、CuSO4溶液的物质的量浓度之比之比为1∶3。
可知,Fe2(SO4)3、CuSO4溶液的物质的量浓度之比之比为1∶3。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是

A.如图可表示水分解过程中的能量变化
B.若2C(s)+O2(g)=2CO(g) △=-221.0kJ/mol,则碳的燃烧热为110.5kJ/mol
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知I:反应H2(g)+Cl2(g)=2HCl(g) △=-akJ/mol
II: ![]()
且a、b、c均大于零,则断开1mol H—Cl键所需的能量为(-a-b-c)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对1L1 molL-1的NH4Cl溶液进行如下操作,溶液的pH增大的是( )
A.加热
B.加入少量的NH4Cl固体
C.加水稀释
D.再加1L 1molL NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将液体A滴入烧瓶与气体B充分反应,打开夹子,可发现试管内的水立刻沸腾了,则液体A和气体B的组合不可能是

A.水、氯化氢
B.硫酸、氨气
C.氢氧化钠溶液、二氧化硫
D.氢氧化钠溶液、一氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各题所给出的数据,得出的结论正确的是
A. 通入标准状况下HC1气体11.2L,可使1L浓度为0.5 mol·L-1的盐酸浓度增大到1 mol·L-1
B. 在10%的NaOH溶液中,平均每9个水分子溶有1个OH-
C. 将10 g碳酸钙粉末加水配成100 mL溶液,CaCO3物质的量浓度为1 mol·L-1
D. 4gNaOH溶解在l0mL水中,再稀释成1L,从中取l mL,这lmL溶液的浓度为0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相等的N2、O2两种气体,它们的温度和密度均相同。下列说法中正确的是( )
A.分子数:N2<O2
B.气体摩尔体积:N2<O2
C.气体的压强:N2<O2
D.体积:N2<O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示铁与不同浓度硝酸反应时,各种还原产物的相对含量与硝酸溶液浓度的关系,则下列说法不正确的是
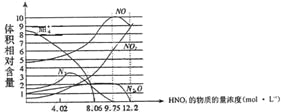
A. 一般来说,硝酸与铁反应的还原产物不是单一的
B. 用一定量的铁粉与大量的9.75mol·L—1HNO3溶液反应得到标态下气体2.24L,则参加反应的硝酸的物质的量为0.1mol.
C. 硝酸的浓度越大,其还原产物中价态越高的成份越多
D. 当硝酸浓度为9.75mol·L—1时还原产物是NO、NO2、N2O,且其物质的量之比为5:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究物质的性质时,首先要分离提纯物质,对物质进行分离提纯是化学实验的重要内容。现需要纯净的氯化钠固体,但实验室中只有混有硫酸钠、碳酸氢铵的氯化钠固体。某同学设计了一个除去杂质获得纯净氯化钠溶液的实验方案:

(1)操作①中发生反应的化学方程式是 。(已知NH4HCO3受热后没有固体剩余,产生的气体中有一种能使红色石蕊试纸变蓝)
(2)操作②中BaCl2 溶液能否改用硝酸钡溶液 (填“能”或“不能”)。如果能,下一空不需要回答;如果不能,请说明理由: 。
(3)操作③的目的是 ;请你用实验方法确认操作③中碳酸钠已过量: 。
(4)操作④的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com