
����Ŀ����ҵ�û�ͭ����Ҫ�ɷ�CuFeS2��������п��Ǧ�����ұ��ͭ��һ�ַ������£�
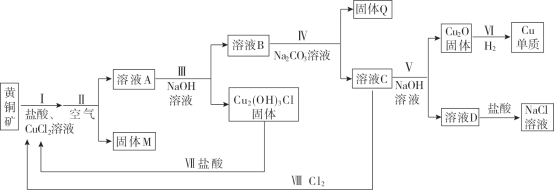
��1�����з������з�Ӧ����.CuFeS2 + 3Cu2+ + 4Cl- = 4CuCl+ Fe2+ +2S��. CuCl + Cl-![]() CuCl2-��I�������������________��
CuCl2-��I�������������________��
��2������ͨ���������Fe2+ת��FeOOH������
��Fe2+ת��ΪFeOOH�����ӷ���ʽ��__________��
����ҺA�к�����Ԫ�ص������У�Zn2+��Pb2+��________��
��3�����������NaOH��Һ����������ԭ����________��
��4�����м���Na2CO3��Һ��Ŀ����________��
��5��V�з�Ӧ�����ӷ���ʽ��________��
��6��������ѭ�����õĽǶȷ�������δ���NaCl��Һ���ܸ��õط����ڸ�ұ��ͭ�Ĺ��գ���˵�����ɣ�__��
���𰸡�����Cl-���ٽ�I�з�Ӧ�����ͭԪ�ؽ����� 4Fe2+ + O2 + 6H2O = 4FeOOH��+ 8H+ Cu2+��CuCl2- ��ֹZn2+��Pb2+������ͬʱ����CuCl2-���Cu2O���� ��ȥZn2+��Pb2+ 2CuCl2- + 2OH- = Cu2O��+4Cl- +H2O ����Ȼ�����Һ����H2��Cl2��NaOH��NaOH������������������������H2������������ԭ����Cl2�����ڢ���������
��������
��1���۲�I�е�������Ӧ������ii�ǿ��淴Ӧ����ʹ��ϡ������Դ�ʹƽ�������ƶ�������ͭԪ�صĽ����ʣ�
��2����Fe2+��O2����FeOOH����Ӧ���л�����H2O������д������ʽ��
�ڸ���I�еķ�Ӧ��Cu(OH)3Cl�������Ƴ���ҺA�л�����Cu2+��CuCl2-��
��3���������У�����ҺA�еõ���Cu(OH)3ClҪ��������Ĵ����õ�CuCl2�����Ҫ��Cu(OH)3Cl�Ĵ���Ҫ�ߣ�����III�п���NaOH��������Ϊ�˷�ֹZn2+��Pb2+�γɳ�����ͬʱҲ�ɱ���CuCl2-���Cu2O������
��4��ͨ��V��VI��֪����ҺC��û���������ӣ��ʢ��м���Na2CO3��Һ��Ϊ�˳�ȥZn2+��Pb2+��
��5����ҺC�е���Ҫ����ΪCuCl2-������ͼ�п�֪�������Ӻ�NaOH��Ӧ������Cu2O���ݴ�д�����ӷ���ʽ��
��6���۲�����ͼ�����Է��ֵ�ⱥ��NaCl��Һ���õIJ���Cl2��H2��NaOH�������ã��ʿ��Ե���Ȼ�����Һ��
��1��ʹ��ϡ���ᣬ��������Cl-��Ũ�ȣ�ʹ�÷�Ӧii��ƽ�������ƶ�������ͭԪ�صĽ����ʣ�
��2����Fe2+ת��ΪFeOOH�����ӷ���ʽΪ4Fe2++O2+6H2O=4FeOOH��+8H+��
�ڻ�ͭ���CuCl2��ϡ���ᷴӦ������������Һͨ��O2�õ���ҺA�������Ƴ���Һ����CuCl2-���ٸ�����ҺA�м���NaOH��Һ�õ�Cu(OH)3Cl�������Ƴ���ҺA�л�����Cu2+��
��3��III�п���NaOH��������Ϊ�˷�ֹZn2+��Pb2+�γɳ�����ͬʱҲ�ɱ���CuCl2-���Cu2O�������Է�ֹCu(OH)3Cl�к������ʣ�
��4�����м���Na2CO3��Һ��Ϊ�˳�ȥZn2+��Pb2+��
��5����ҺC�е���Ҫ����ΪCuCl2-������ͼ�п�֪�������Ӻ�NaOH��Ӧ������Cu2O����Ӧ�����ӷ���ʽΪ��2CuCl2-+2OH-=Cu2O��+4Cl- +H2O��
��6����ͼ��ʾ������Ȼ�����Һ����H2��Cl2��NaOH��NaOH�����ڢ�������������H2�����ڢ�����ԭ����Cl2�����ڢ�����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ʾҳ������ijЩ����Ľṹģ�ͣ�

(1)�л��������Ϊ____________���л�������л����һ�Ϊ____________��
(2)�л����ҵ�һ��ȡ������________�֣�������ݼ�����ӽṹʾ��ͼ�Ʋ⣬�л������������________��Cԭ����ͬһƽ���ڡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������м������ʣ��뽫����������пո��ڣ�
A��CH2=CH��COOH�����ᣨC17H33COOH��
B��12C60��ʯī
C��![]() ��
��![]()
D��35Cl��37Cl
E���Ҵ����Ҷ���
��1����Ϊͬλ�ص��� ��
��2����Ϊͬϵ����� ��
��3����Ϊͬ����������� ��
��4����Ϊͬ���칹����� ��
��5���Ȳ���ͬϵ��ֲ���ͬ�����壬Ҳ����ͬ�������壬���ɿ�����ͬһ�����ʵ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ�����ȡ���ϡ��㾫��Ⱦ�ϡ�Ϳ�ϡ�ϴ�Ӽ��Ȳ�Ʒ��ԭ�ϡ�
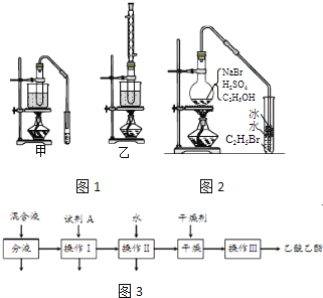
���������գ�
��1��ʵ�������Ҵ���ȡ��ϩʱ��Ũ���������ԶԶ������Ϊ����������������ԭ����______��
��2����֤��ϩ�ӳɷ�Ӧ����ʱ�������ϩ�����еĸ������ʽ��д�������ѡ�õ��Լ���_____����д��ѧʽ������ȷ����ϩͨ����ˮ�з����˼ӳɷ�Ӧ����ʵ��______����ѡ���ţ�
a����ˮ��ɫ b������״��������
c����Ӧ��ˮ��Һ������ǿ d����Ӧ��ˮ��Һ�ӽ�����
��3��ʵ�������Ҵ��������Ʊ���������ʱ���ס�������װ����ͼ1������ѡ�á�����������װ�õ�˵����ȷ����______����ѡ���ţ�

a����װ������ת���ʸ� b����װ������ת���ʸ�
c����װ��������������ʩ d����װ��������������ʩ
��4������װ��ʵ��ʱ���ᴿ��������������������ͼ3�����������Լ�A�Ļ�ѧʽ��______���������������______��������һ�������ڷ���______����
��5����ͼ2�����Ҵ��Ʊ��������װ�ã�ʵ���������ּ��Ϸ�����
���ȼ��廯�����ټ��Ҵ�������1��1Ũ���
���ȼ��廯�����ټ�1��1Ũ�����������Ҵ���
�������ٺ͢�ʵ��ʱ�����ﶼ��������ɫ�������Թ��м���______������ɱ�Ϊ��ɫ���뷽������Ƚϣ������ڵ�����ȱ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Ϊ������Ԫ�أ�������Ԫ�����ڱ������λ����ͼ��ʾ����Zԭ�ӵ������������ǵ�һ���������3��������˵����ȷ���ǣ�������
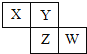
A.Z������������Ӧ��Y����
B.X��W��ԭ�Ӻ�����������9
C.X����������ǿ��Y����
D.����������Ӧˮ��������W��Zǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaOH��Һ��ϴ�Թܱ��ϵ�������ӦS��NaOH��Na2SO3��Na2S��H2O��δ��ƽ��������˵������ȷ����
A.����ʽ�к���Ԫ�صĻ�����������Ӽ����ۼ�
B.���ɵ�Na2SO3 ��Na2S�����ʵ���֮��Ϊ1 : 2
C.����ʽ��S��H2O�Ļ�ѧ��������ͬ
D.��ϴ֮��ķ�Һ�ʼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����a g�������̷�ĩ����b mol/L��Ũ����c L�м�����ȫ�ܽ⣬��Ӧ��ת�Ƶ���d������NAΪ�����ӵ�������ֵ������������ȷ����
A.�����ռ�������![]() L
L
B.NA�ɱ�ʾΪ��![]()
C.��Ӧ����Һ�е�Cl�D��ĿΪ��![]()
D.��Ӧ����Һ�е�H����ĿΪ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л�ѧƽ����һ�������·����ƶ�������������ȷ����
A.Cl2+H2O![]() HCl+HClO����ˮ�м���̼��ƣ�Ư������ǿ
HCl+HClO����ˮ�м���̼��ƣ�Ư������ǿ
B.ZnS + Cu2+![]() CuS + Zn2+����п��(ZnS)��CuSO4��Һת��Ϊͭ��(CuS)
CuS + Zn2+����п��(ZnS)��CuSO4��Һת��Ϊͭ��(CuS)
C.2NO2![]() N2O4 ��H��0����װ��NO2�IJ����������ˮ�У�����ɫ��dz
N2O4 ��H��0����װ��NO2�IJ����������ˮ�У�����ɫ��dz
D.Cr2O72��(��ɫ)+H2O![]() 2CrO42��(��ɫ) +2H+��K2Cr2O7��Һ�еμӼ���Ũ���ᣬ��ɫ����
2CrO42��(��ɫ) +2H+��K2Cr2O7��Һ�еμӼ���Ũ���ᣬ��ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ѧ�û�ѧ֪ʶ����Ҫ�����������йػ�ѧ�����ʾ��ȷ���У� ��
���õ���ʽ��ʾHCl���γɹ��̣�![]()
��MgCl2�ĵ���ʽ��![]()
��������Ϊ133��������Ϊ78���ԭ�ӣ�![]() Cs
Cs
��S2���Ľṹʾ��ͼ��![]()
����������ӵĽṹʽ��H-O-Cl
�� CO2�ķ��ӱ���ģ��ʾ��ͼ:![]()
A.2��B.3��C.4��D.5��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com