


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
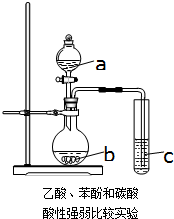 化学研究性学习小组进行验证乙酸、碳酸和苯酚溶液的酸性强弱的探究实验.设计如图一次性完成乙酸、碳酸和苯酚溶液酸性强弱验证的实验装置.
化学研究性学习小组进行验证乙酸、碳酸和苯酚溶液的酸性强弱的探究实验.设计如图一次性完成乙酸、碳酸和苯酚溶液酸性强弱验证的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
| A、R的氧化物对应的水化物可能具有两性 |
| B、X单质在氧气中燃烧不可能生成XO3 |
| C、离子半径大小:r(M3+)>r(T2-) |
| D、L2+和X2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑤⑥ | B、①②④⑥ |
| C、①②⑤⑥ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在如图中,甲烧杯中盛有100mL 0.50mol?L-1 AgNO3溶液,乙烧杯中盛有100mL 0.25mol?L-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.52g,则
在如图中,甲烧杯中盛有100mL 0.50mol?L-1 AgNO3溶液,乙烧杯中盛有100mL 0.25mol?L-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.52g,则查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
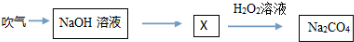
| A、Na2CO4是一种盐,其中碳为+6价 |
| B、X溶液中可能含两种盐 |
| C、该过程中没有发生氧化还原反应 |
| D、NaHCO3与盐酸和氢氧化钠均能反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com