
| A. | N60高温和撞击后应该生成N2 | B. | N60和N2都是氮的同素异形体 | ||
| C. | N60中氮原子之间由共价键结合 | D. | N60和14N都是氮的同位素 |
分析 “分子足球”N60与C60分子结构相似,则均为共价键形成的分子,且均为单质,以此来解答.
解答 解:A.由信息N60在高温和撞击后会释放出巨大能量,转化为稳定物质氮气,则N60高温和撞击后应该生成N2,故A正确;
B.N60和N2都是单质,且均只含N元素,则均为氮的同素异形体,故B正确;
C.只有一种非金属元素,可知N60中氮原子之间由共价键结合,故C正确;
D.N60为单质,14N为原子,二者不是同位素关系,故D错误;
故选D.
点评 本题考查共价键的形成及物质分类,为高频考点,把握信息及基本概念的迁移应用为解答的关键,侧重分析与应用能力的考查,注意A为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
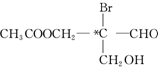 有光学活性.该有机物分别发生下列反应,生成的有机物仍有光学活性的是( )
有光学活性.该有机物分别发生下列反应,生成的有机物仍有光学活性的是( )| A. | 与乙酸发生酯化反应 | B. | 与NaOH水溶液反应 | ||
| C. | 与银氨溶液作用只发生银镜反应 | D. | 催化剂作用下与H2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
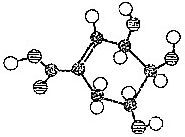
 的化学方程式:
的化学方程式: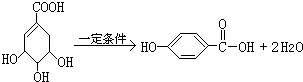 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
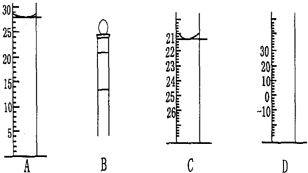
| 滴定序 号 | 待测液体积/mL | 所消耗盐酸标准液的体积/mL | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V | 0.50 | 25.52 | 25.02 |
| 2 | V | 0.40 | 24.40 | 24.00 |
| 3 | V | 1.00 | 25.98 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
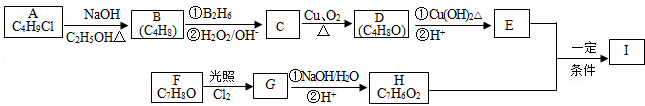
 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag | |
| B. | 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 硫酸钠溶液和氯化钡溶液反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com