

| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
分析 要利用制作印刷电路的废液制备氯化亚铜,首先应制备并分离出铜,向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜.
(1)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜;过滤后滤渣中含有铜和铁,依据铜和铁的活泼性,加入盐酸分离二者;
(2)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒配平方程式;
(3)依据图示可知:铜与浓硫酸反应生成硫酸铜、二氧化硫的物质的量之比为1:1,而产生CuCl的化学方程式中硫酸铜、二氧化硫物质的量之比恰好为1:1;
(4)依据氯化亚铜具有还原性,易被氧化而变质,具有见光分解的性质解答;
(5)依据图表CuCl产率可知PH=2产率最大,当pH较大时CuCl产率变低,Cu2+水解程度增大,生成的氯化亚铜少;
(6)依据方程式中各反应物量之间的关系计算CuCl的纯度,CuCl+FeCl3═CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+,CuCl~Ce4+,所给数据及平行实验结果相差不能超过1%,体积为24.35mL,误差大舍去.
解答 解:向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜.
(1)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜,过滤后滤渣中含有铜和铁,加入盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,将铜分离出来;
故答案为:Fe;HCl;
(2)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒其方程式为:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
故答案为:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
(3)依据图示可知:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体;
故答案为:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体;
(4)氯化亚铜具有还原性,易被氧化而变质,具有见光分解,所以生产中应:防止CuCl的氧化和见光分解,减少产品CuCl的损失;
故答案为:防止CuCl的氧化和见光分解,减少产品CuCl的损失;
(5)依据图表CuCl产率可知pH=2产率最大为90%,当pH较大时CuCl产率变低,Cu2+水解程度增大,生成的氯化亚铜少;
故答案为:2;pH较大时,Cu2+水解程度增大,反应生成CuCl减少,产率减小;
(6)根据题目中所给数据及平行实验结果相差不能超过1%,体积为24.35mL,误差大舍去,滴定0.25g样品消耗硫酸铈标准溶液的平均体积=$\frac{24.05+23.95}{2}$=24mL,结合方程式可知:CuCl+FeCl3═CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+,
CuCl~Ce4+,
CuCl的纯度=$\frac{24×1{0}^{-3}L×0.1mol/L×99.5g/mol}{0.25g}$×100%=95.5%,
故答案为:95.5%.
点评 本题为工艺流程题,为高考热点和难点,设计物质的分离、物质的制备,明确物质的性质是解题关键,题目难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | vA=0.5mol/L•s | B. | vB=0.6mol/L•s | C. | vC=0.4mol/L•s | D. | vD=2mol/L•min |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 过碳酸钠(2Na2CO3•3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,易分解.可用纯碱与H2O2反应制取,反应方程式为:2Na2CO3(aq)+3H2O2(aq)?2Na2CO3•3H2O2(s)△H<0,如图是制取过碳酸钠 的示意图,步骤如下
过碳酸钠(2Na2CO3•3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,易分解.可用纯碱与H2O2反应制取,反应方程式为:2Na2CO3(aq)+3H2O2(aq)?2Na2CO3•3H2O2(s)△H<0,如图是制取过碳酸钠 的示意图,步骤如下查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.7 | 7.5 | 1.4 |
| 沉淀完全pH | 6.7 | 14 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与足量酸性高锰酸钾反应 | B. | 依次通入通入足量溴水和浓硫酸中 | ||
| C. | 在一定条件下通入H2 | D. | 分别进行燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同系物的化学性质相似 | |
| B. | 同系物的分子组成相差一个或几个CH2原子团 | |
| C. | 若烃中碳、氢元素的质量分数相同,它们必定是同系物 | |
| D. | 互为同分异构体的两种有机物的物理性质有差别,但化学性质可能相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
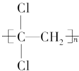 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由CCl2=CH2(写结构简式)发生加聚反应生成的.
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由CCl2=CH2(写结构简式)发生加聚反应生成的.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
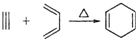 ,如果要合成
,如果要合成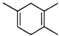 所用的原始原料可以是( )
所用的原始原料可以是( )| A. | 2-甲基-l,3-丁二烯 和 2-丁炔 | B. | 1,3-戊二烯 和 2-丁炔 | ||
| C. | 2,3-二甲基-1,3-戊二烯 和 乙炔 | D. | 2,3-二甲基-l,3-丁二烯 和 丙炔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com