

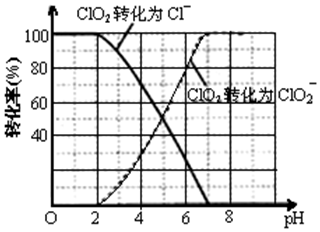
分析 无隔膜电解槽中持续电解饱和氯化钠溶液,2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,则电解生成的氯气和氢氧化钠反应生成氯酸钠溶液,通二氧化硫和X酸还原氯酸钠溶液生成二氧化氯,再用双氧水、氢氧化钠吸收反应生成亚氯酸钠,过滤的亚氯酸钠(NaClO2)溶液通过蒸发结晶得到亚氯酸钠晶体.
(1)根据电解池中阳极失去电子结合产物书写,电解槽中持续电解一段时间后,生成氢气和NaClO3,阳极上Cl失去电子;
(2)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在.由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸;
(3)H2O2不稳定,温度过高,H2O2容易分解;
(4)根据图象可知,pH≤2时ClO2被还原为Cl-,硫离子被氧化成硫单质;
(5)根据ClO2将CN-氧化,生成了两种无毒无害的气体即二氧化碳和氮气来书写方程式并计算.
解答 解:(1)电解池中阳极失去电子,所以溶液中的氯离子在阳极失去电子,因此反应的电极反应式是Cl--6e-+6OH-=ClO3-+3H2O,
故答案为:Cl--6e-+6OH-=ClO3-+3H2O;
(2)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在.由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸;
故答案为:B;
(3)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解,
故答案为:温度过高H2O2将分解;
(4)ClO2具有氧化性,S2-具有还原性,根据图象可知,pH≤2时ClO2被还原为Cl-,所以该反应的离子方程式是2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O;
故答案为:2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O;
(5)ClO2将CN-氧化,生成了两种无毒无害的气体即二氧化碳和氮气,所以离子方程式为:2ClO2+2CN-=2Cl-+2CO2+N2↑;根据方程式1molCN-离子消耗1mol二氧化氯,所以处理100m3这种污水,至少需要ClO2为$\frac{100×1{0}^{3}×a×1{0}^{-3}}{26}$mol=$\frac{100a}{26}$mol,
故答案为:2ClO2+2CN-=2Cl-+2CO2+N2↑;$\frac{100a}{26}$.
点评 本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考查学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而增大有效碰撞的次数 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂不影响反应活化能但能增大单位体积内活化分子的百分数,从而增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
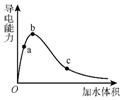 一定温度下,将一定量的纯醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的纯醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离度:c<b<a | |
| B. | 溶液的pH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的pH试纸上,测得pH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝均剩余 | |
| B. | 金属铝均溶解 | |
| C. | 盐酸中铝剩余,而氢氧化钠中铝全部溶解 | |
| D. | 氢氧化钠这铝剩余,而盐酸中铝全部溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐、醋、糖都有防腐功效 | |
| B. | 煤粉碎后更易燃烧,是因为粉碎增强了煤的还原性 | |
| C. | 鸡蛋煮熟后,蛋白质水解成了氨基酸 | |
| D. | 月饼包装中的还原铁粉小包和旺旺仙贝包装中的生石灰小包的作用相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com