
| A、KOH+CH3COOH=CH3COOK+H2O |
| B、Ba(OH)2+H2SO4=BaSO4↓+2H2O |
| C、Cu(OH)2+H2SO4=CuSO4+2H2O |
| D、2NaOH+H2SO4=Na2SO4+2H2O |
科目:高中化学 来源: 题型:
| A、称取10.2g Na2CO3,配成1000mL溶液 |
| B、称取10.6g Na2CO3,配成1000mL溶液 |
| C、称量固体时,天平指针偏右 |
| D、定容时俯视液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉长时间露置空气中会结块变质 |
| B、大气中氮的氧化物主要来源是汽车排出的尾气 |
| C、NH3易液化,液氨常用作制冷剂 |
| D、蘸有浓硫酸的玻璃棒接近浓氨水瓶口有白烟产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化剂与还原剂的物质的量之比为1:8 |
| B、还原产物为NH4+ |
| C、若有1 mol NO3-参加氧化反应,则转移8 mol电子 |
| D、该过程说明Fe(NO3)2溶液不宜加酸酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
| 转换 |
| Fe2+ |
| 还原 |
| OH- |
| 沉淀 |
| 10 |
| 11 |
| A、若用绿矾(FeSO4?7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g |
| B、溶液颜色保持不变,说明上述可逆反应达到达平衡状态 |
| C、常温下转换反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D、常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体的分散质能透过滤纸 |
| B、胶体能产生丁达尔现象 |
| C、胶体是纯净物,其它分散系是混合物 |
| D、胶体的分散质粒子直径在1~100 nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、⑥⑦⑧⑨ | B、②④⑥⑧ |
| C、③④⑦⑧ | D、②④⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,28 g氮气所含的原子数为2NA |
| B、1 mol氯化氢约含有6.02×1023个粒子 |
| C、22.4 L甲烷(CH4)所含的原子数为5 NA |
| D、2.4 g镁原子变成离子时,失去的电子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
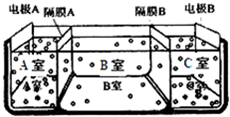 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com