
分析 甲厂的废水明显呈碱性,则溶液中含有大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,根据溶液电中性可知甲厂废水中应含有K+,乙厂中含有Ag+、Fe3+,则与Ag+、Fe3+反应的Cl--、OH-不能共存,根据溶液电中性可知乙厂还有NO3-,以此来解答.
解答 解:甲厂的废水明显呈碱性,则溶液中含有大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,根据溶液电中性可知甲厂废水中应含有K+,乙厂中含有Ag+、Fe3+,则与Ag+、Fe3+反应的Cl--、OH-不能共存,根据溶液电中性可知乙厂还有NO3-,由此可知:甲厂含有K+、Cl-、OH-,乙厂含有Ag+、Fe3+、NO3-,
故答案为:OH-、Cl-、K+;Ag+、Fe3+、NO3-.
点评 本题考查离子的共存,为高频考点,把握甲厂的废水呈明显碱性及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
| A. | 同质量的气体A与气体B,所含分子数目之比为a:b | |
| B. | 气体A与气体B的摩尔质量之比为a:b | |
| C. | 相同条件下,a g气体A与b g气体B体积之比为b:a | |
| D. | 相同条件下,气体A与气体B的密度之比为b:a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
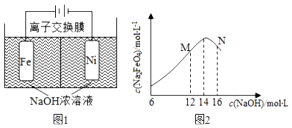
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
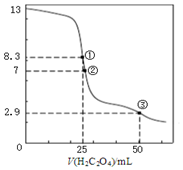 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法不正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法不正确的是( )| A. | 点①所示溶液中:c(H+)+2c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=0.0500mol•L-1 | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
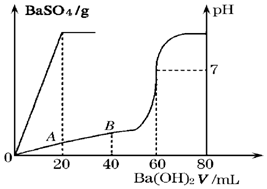 表中是不同温度下水的离子积的数据:
表中是不同温度下水的离子积的数据:| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
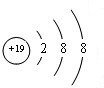
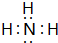 ;⑨的最高价氧化物对应的水化物
;⑨的最高价氧化物对应的水化物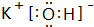 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷是硅酸盐产品 | B. | 葡萄糖可用于制镜业 | ||
| C. | 纸的主要成分为纤维素 | D. | 汉白玉的主要成分碳酸钙属于碱类 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com