

| n |
| V |
| n |
| V |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
| A、常温常压下,11.2LN2含有的分子数为0.5NA |
| B、71gCl2 所含原子数为2 NA |
| C、2L 0.3mol/L K2SO4溶液中K+浓度为1.2mol/L |
| D、标况下,1molO2与22.4LH2O中所含分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
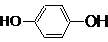
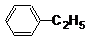
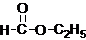
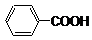
查看答案和解析>>
科目:高中化学 来源: 题型:
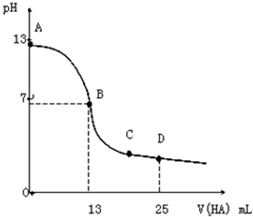 常温下,向25mL 0.1mol?L-1 MOH 溶液中逐滴加入0.2mol?L-1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol?L-1 MOH 溶液中逐滴加入0.2mol?L-1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
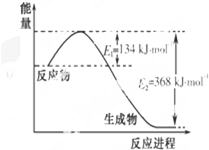 氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| 1 |
| 2 |
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、反应①是置换反应 |
| B、反应②是复分解反应 |
| C、①中TiO2是氧化剂 |
| D、反应②中金属镁是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、充电时K+向阳极移动 |
| B、放电时正极附近的pH逐渐增大 |
| C、充电时阴极的电极反应为:Zn(OH)2+2e-=Zn+2OH- |
| D、充电时每生成1mol Ag2O转移1 mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com