
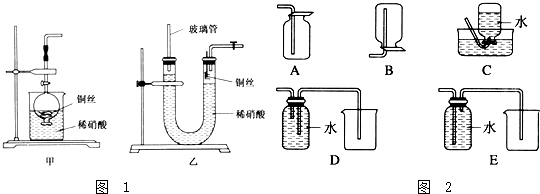
分析 Ⅰ.(1)金属铜和稀硝酸反应生成硝酸铜、一氧化氮以及水;
(2)①实验室若没有铜丝,铜粒以代替铜丝进行实验,则包裹桶里的不能是金属铁以及金属铝,因为他们的活泼性强于金属铜,会先于金属铜和硝酸之间发生反应;
②试管内有空气,NO容易被氧化为红棕色的气体二氧化氮;
(3)①一氧化氮是难溶于水的气体,当制取一氧化氮的装置产生一氧化氮气体时,气体难溶于水,气体把U形管的液体压出;
②利用反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止;
(4)NO能与O2反应,不能用排空气法收集,NO难溶于水,可用排水法收集;
(5)铜和硝酸反应,铜失去电子,硝酸得到电子变成一氧化氮,NO与氧气、水反应又得到硝酸,纵观整个过程Cu失去电子等于氧气获得电子,根据电子转移守恒计算需要氧气物质的量,进而计算氧气体积;
II.Cu与浓硝酸或稀硝酸反应分别生产NO2、NO等污染环境的有毒气体,丙方案用到Cl2,能污染环境,制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体.
解答 解:Ⅰ.(1)金属铜可以和稀硝酸之间反应生成硝酸铜、一氧化氮以及水,即3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,离子方程式为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑,
故答案为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑;
(2)①实验室若没有铜丝,铜粒以代替铜丝进行实验,则包裹桶里的不能是金属铁以及金属铝,因为他们的活泼性强于金属铜,会先于金属铜和硝酸之间发生反应,
故答案为:CD;
②试管内有空气,NO容易被氧化为红棕色的气体二氧化氮,反应方程式为:2NO+O2═2NO2,
故答案为:2NO+O2═2NO2;
(3)①一氧化氮是难溶于水的气体,当制取一氧化氮的装置产生一氧化氮气体时,气体难溶于水,气体把U形管的液体压出,所以长玻璃管的作用是:接收被气体压出U形管的液体,防止稀硝酸溢出,
故答案为:接收被气体压出U形管的液体,防止稀硝酸溢出;
②让反应停止的操作方法及原因是:关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止,
故答案为:关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止;
(4)NO能与O2反应,不能用排空气法收集,NO难溶于水,可用排水法收集,CD正确,
故答案为:CD;
(5)铜和硝酸反应,铜失去电子,硝酸得到电子变成一氧化氮,NO与氧气、水反应又得到硝酸,纵观整个过程Cu失去电子等于氧气获得电子,Cu的物质的量为$\frac{12.8g}{64g/mol}$=0.2mol,根据电子转移守恒,需要氧气物质的量为$\frac{0.2mol×2}{4}$=0.1mol,故需要氧气体积至少为0.1mol×22.4L/mol=2.24L,
故答案为:2.24L;
II.Cu与浓硝酸或稀硝酸反应分别生产NO2、NO等污染环境的有毒气体,丙方案用到Cl2,能污染环境,制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体,所以4种方法中最好的是丁,
故答案为:丁,制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体.
点评 本题考查实验方案的设计与评价、方程式的书写、化学计算等,制备实验中渗透环保意识、原子经济意识,是对学生综合能力的考查.


科目:高中化学 来源: 题型:解答题
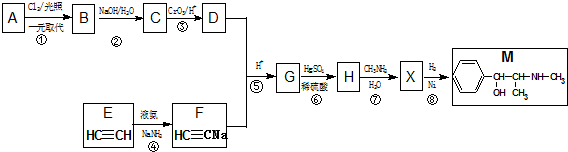
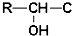 ≡C-R′
≡C-R′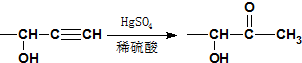
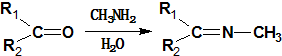
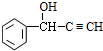 .
. +CH3NH2$\stackrel{水}{→}$
+CH3NH2$\stackrel{水}{→}$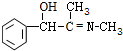 +H2O.
+H2O.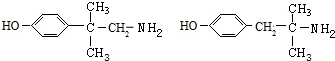 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
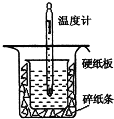 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
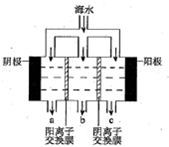 海水中主要离子的含量如下:
海水中主要离子的含量如下:| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
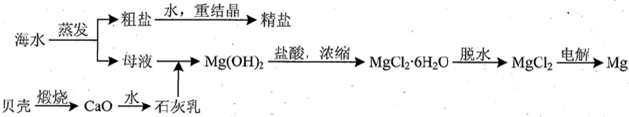
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4═Na++HSO4- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2CO3?2H++CO32- | D. | A12(SO4)3═2A13++3SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
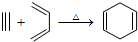 ,如果要合成
,如果要合成 所用的原始原料可以是( )
所用的原始原料可以是( )| A. | 2-甲基-1,3-丁二烯和2-丁炔 | B. | 1,3-戊二烯和2-丁炔 | ||
| C. | 2,3-二甲基-1,3-戊二烯和乙炔 | D. | 2,3-二甲基-1,3-丁二烯和1-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
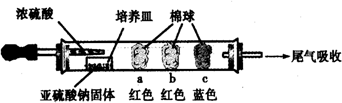
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | SO2具有漂白性,且为暂时性漂白 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 该气体具有还原性 (选填“氧化性”或“还原性”) |
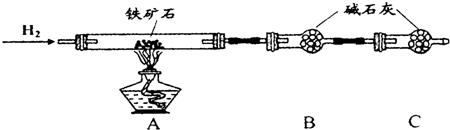
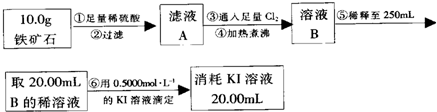
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
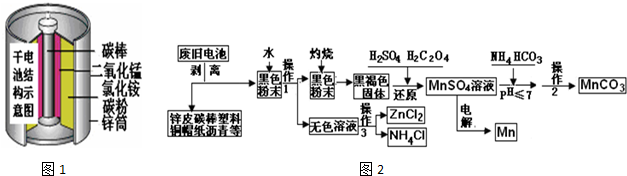
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com