
酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可得到多种化工原料。有关数据如下表
溶解度/(g/100g水)
|
化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为________,电池反应的离子方程式为________。
(2)维持电流强度为0.5
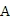 ,电池工作5分钟,理论上消耗锌________
,电池工作5分钟,理论上消耗锌________
 。(已知
。(已知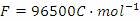
 )
)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有
 ,二者可通过_____分离回收;滤渣的主要成分是
,二者可通过_____分离回收;滤渣的主要成分是
 、_______和_______,欲从中得到较纯的
、_______和_______,欲从中得到较纯的
 ,最简便的方法为_________,其原理是_________。
,最简便的方法为_________,其原理是_________。
(4)用废电池的锌皮制备
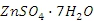 的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀
的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀
 溶解,铁变为______,加碱调节至pH为_______时,铁刚好沉淀完全(离子浓度小于
溶解,铁变为______,加碱调节至pH为_______时,铁刚好沉淀完全(离子浓度小于
 时,即可认为该离子沉淀完全);继续加碱至pH为_____时,锌开始沉淀(假定
时,即可认为该离子沉淀完全);继续加碱至pH为_____时,锌开始沉淀(假定
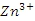 浓度为0.1mol
浓度为0.1mol
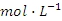 )。若上述过程不加
)。若上述过程不加
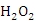 后果是______,原因是_______.
后果是______,原因是_______.
【答案:】(1)MnO2+H++e-=MnOOH 、Zn+ 2MnO2+2H+=Zn2++2 MnOOH
(2)0.05g
(3)加热浓缩、冷却结晶 ;碳粉;MnOOH;空气中加热 ;碳粉变为二氧化碳,MnOOH变为MnO2
(4)Fe3+ ;2.7;6;锌离子和二价铁离子无法分离 ;它们的Ksp 相近无法分离
【解析:】此题考酸性锌锰干电池,(1)Zn做负极,Zn-2e-=Zn2+MnO2做正极,溶液显酸性,由MnO2得电子,电极反应为MnO2+H+e-=MnOOH,两极相加总反应就是Zn+ 2MnO2+2H+=Zn2++2 MnOOH ,(2)维持电流强度为0.5
 ,电池工作5分钟,理论上消耗锌为0.0007mol.所以质量为0.05g,(3)废电池糊状填充物加水处理后,过滤,滤液中主要有
,电池工作5分钟,理论上消耗锌为0.0007mol.所以质量为0.05g,(3)废电池糊状填充物加水处理后,过滤,滤液中主要有
 ,两个溶解度一个受温度影响较大,一个较小,可用重结晶法,二者可通过加热浓缩,冷却结晶分离回收,碳粉和MnOOH都不溶,所以最后还有碳粉和MnOOH,根据碳粉和MnOOH性质,在空气中加热碳粉变为二氧化碳,MnOOH变为MnO2(4)H2O2具有强氧化性把Fe直接变成三价铁离子,根据溶度积原理,Ksp Fe(OH)3= Fe3+ .(OH-)3,(OH-)3= Ksp Fe(OH)3/Fe3+
,两个溶解度一个受温度影响较大,一个较小,可用重结晶法,二者可通过加热浓缩,冷却结晶分离回收,碳粉和MnOOH都不溶,所以最后还有碳粉和MnOOH,根据碳粉和MnOOH性质,在空气中加热碳粉变为二氧化碳,MnOOH变为MnO2(4)H2O2具有强氧化性把Fe直接变成三价铁离子,根据溶度积原理,Ksp Fe(OH)3= Fe3+ .(OH-)3,(OH-)3= Ksp Fe(OH)3/Fe3+
(OH-)3=1034,Kw=H+ .OH-得出H+=10-2.7,所以PH为2.7,同理可得继续加碱至pH为6时,锌开始沉淀,若上述过程不加
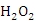 后果是锌离子和二价铁离子无法分离,因为它们的Ksp 相近无法分离。
后果是锌离子和二价铁离子无法分离,因为它们的Ksp 相近无法分离。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
A、B、C是大家熟悉的与生命运动密切相关的三种化合物,它们所含元素不超过三种,并有下图所示的转化关系。其中化合物D也是日常生活中常见的化合物,在一定条件下可与单质X发生如下变化:D+3X―→3A+2B,回答下列有关问题:
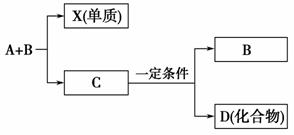
(1)在A、B、C、D四种化合物中,所含元素相同的是(写物质名
称)______________________。
(2)常温下,A和B是通过________________转化成C的,该转化的实质是
__________________________________________________________________
_________________________________________________________________。
(3)目前,化合物B在自然界中的含量逐渐上升,它会引起________________
_________________________________________________________________。
(4)写出D跟浓硫酸和乙酸共热时的反应方程式:______________________
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用右图所示装置进行下列实验,实验结果与预测的现象不一致的是
| ①中的物质 | ②中的物质 |
| |
| A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
| B | 酚酞溶液 | 浓盐酸 | 无明显变化 |
| C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
| D | 湿润红纸条 | 饱和氨水 | 红纸条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生。为探究该反应原理,该同学做了以下试验并观察到相关现象,由此得出的结论不合理的是:
| 选项 | 实验及现象 | 结论 |
| A | 将湿润的红色石蕊试纸放 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同事测得溶液的pH为8.0 | 弱碱性溶液中Mg也可被氧化 |
| D | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 | 弱碱性溶液中OH-氧化了Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体。原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )[多选]
A.231.5mL B.268.8mL C.287.5mL D.313.6
查看答案和解析>>
科目:高中化学 来源: 题型:
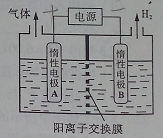
利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为__________溶液(填化学式),阳极电极反应式为__________ ,电解过程中Li+向_____电极迁移(填“A”或“B”)。
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
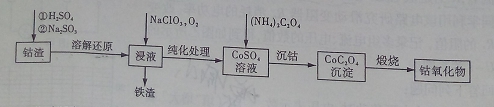
Co(OH)3溶解还原反应的离子方程式为____________________________________,铁渣中铁元素的化合价为___________,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
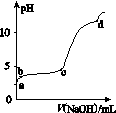
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH-Al(OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com