
| A. | pH=3的醋酸溶液稀释100倍后,溶液的pH=5 | |
| B. | pH=2的盐酸与等体积0.01 mol?L-1醋酸钠混合溶液后,溶液中c(Cl-)=c(CH3COO-) | |
| C. | 氨水中通入过量CO2后,溶液中c(H+)+c(NH4+)=c(OH-)+c(HCO3-) | |
| D. | 0.1mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)>c(I-) |
分析 A.弱电解质在水溶液里存在电离平衡,加水稀释促进电离;
B.pH=2的盐酸溶液中氢离子浓度为0.01mol/L与等体积0.01 mol?L-1醋酸钠混合溶液后生成醋酸和氯化钠,醋酸是弱酸;
C.氨水中通入过量CO2后反应生成碳酸氢铵,溶液中存在电荷守恒判断;
D.AgCl与AgI的溶度积不同,氯化银溶解性大于碘化银,所得溶液中c(Cl-)>c(I-).
解答 A.醋酸中存在电离平衡,醋酸为弱电解质溶液中存在电离平衡,加水稀释促进电离,pH=3的醋酸溶液稀释100倍后溶液的pH<5,故A错误;
B.pH=2的盐酸溶液中氢离子浓度为0.01mol/L与等体积0.01 mol?L-1醋酸钠混合溶液后生成醋酸和氯化钠,醋酸是弱酸,溶液中c(Cl-)>c(CH3COO-),故B错误;
C.氨水中通入过量CO2后反应生成碳酸氢铵,溶液中存在电荷守恒,c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-),故C错误;
D.均存在溶解平衡,溶液中Ag+浓度相同,AgCl与AgI的溶度积不同,氯化银溶解性大于碘化银,所得溶液中c(Cl-)>c(I-),故D正确;
故选D.
点评 本题侧重对化学反应原理考查,涉及弱电解质电离平衡、盐类水解、沉淀溶解平衡等,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
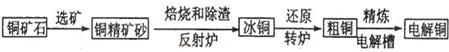
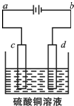
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.10 mol•L-1 CH3COONa溶液中通入HCl气体至pH<7:c(CH3COO-)+c(CH3COOH)<c(Na+) | |
| B. | 0.10 mol•L-1 CH3COONa溶液中通入HCl气体至pH=7:c(Na+)>c(Cl-)=c(CH3COOH) | |
| C. | 20 mL 0.10 mol•L-1 CH3COONa溶液与10 mL 0.10 mol•L-1 HCl溶液混合得到的酸性溶液:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) | |
| D. | 20 mL 0.10 mol•L-1 CH3COONa溶液与10 mL 0.10 mol•L-1 HCl溶液混合得到的酸性溶液:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②⑤ | C. | ③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 气体和水反应的化学方程式 | 是否氧化还原反应 (填“是”或“否”) | |
| X+H2O | ||
| Y+H2O | ||
| Z+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
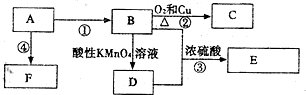
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com