
| A. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 澄清石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 稀硫酸除铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 硫酸和Ba(OH)2反应:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
分析 A.FeCl3溶液在沸水中水解生成氢氧化铁胶体,胶体不是沉淀;
B.澄清石灰水中氢氧化钙为离子形式;
C.Fe2O3与酸反应生成铁离子和水;
D.氢离子、氢氧根离子的系数错误,不满足硫酸、氢氧化钡的化学式组成.
解答 解:A.FeCl3溶液在沸水中水解生成氢氧化铁胶体,胶体不是沉淀,正确的离子方程式为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,故A错误;
B.澄清石灰水与稀盐酸反应,反应的离子方程式为:OH-+H+═H2O,故B错误;
C.Fe2O3与酸反应生成铁离子和水,反应的离子方程式为:Fe2O3+6H+═2Fe3++3H2O,故C正确;
D.氢氧化钡溶液与稀硫酸反应生成硫酸钡沉淀和水,正确的离子方程式为:Ba2++SO42-+2H++2OH-═BaSO4↓+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的正误判断,题目难度中等,试题侧重于元素化合物的性质的综合应用,注意物质的化学式、电荷守恒和质量守恒的判断.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
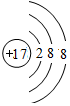 ,离子半径最大的是S 2-.
,离子半径最大的是S 2-.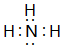 ;⑤的一种氧化物呈淡黄色,其含有的化学键类型有离子键和共价键,电子式为
;⑤的一种氧化物呈淡黄色,其含有的化学键类型有离子键和共价键,电子式为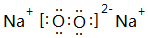 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
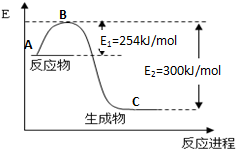 到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.| 化学键 | H-H | N≡N |
| 键能(kJ/mol) | 435 | 943 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b,则容器中可能使用了催化剂或恒温恒容下充入惰性气体 | |
| B. | 在该温度下,保持容积固定不变,向容器内补充了B气体,则a<b | |
| C. | 若其他条件不变,升高温度,则a<b | |
| D. | 若保持温度、压强不变,充入惰性气体,则a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0,△S>0的反应在所有温度下都能自发进行 | |
| B. | NH4HCO3(s)=NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在任何温度下都能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1mol水的体积是22.4L | |
| B. | 1molH2所占的体积一定是22.4L | |
| C. | 在标准状况下,NA个任何分子所占的体积约为22.4L | |
| D. | 在标准状况下,质量为28g的CO气体,其体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 | |
| B. | 分子组成符合CnH2n+2的烃一定是烷烃 | |
| C. | 正戊烷分子中所有原子均在一条直线上 | |
| D. | CH3CH(CH3)2在光照下与氯气反应,可以生成四种一氯代烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变压强,平衡不发生移动,反应放出的热量不变 | |
| B. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| C. | 若在原电池中进行,反应放出的热量不变 | |
| D. | 升高温度,反应速率加快,反应放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4mol | B. | 2mol | C. | 1mol | D. | 3mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com