
| Ksp(AgBr) |
| c(Br-) |
| Ksp(AgBr) |
| 4.9×10-13 |


科目:高中化学 来源: 题型:
| A、NaHSO4溶液和Ba(OH)2溶液反应后呈中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| B、实验室制取CO2:CO32-+2H+═CO2↑+H2O |
| C、铁和硝酸银溶液反应:Fe+Ag+=Ag+Fe3+ |
| D、硫酸铜溶液跟氢氧化钡溶液反应:Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验C2H5Br中的Br元素时,将C2H5Br和NaOH溶液混合加热后,加硫酸酸化 |
| B、为提高KMnO4溶液的氧化能力,用浓盐酸将KMnO4溶液酸化 |
| C、检验蔗糖在稀硫酸中水解产生的葡萄糖,应先用NaOH溶液碱化后才能进一步检验 |
| D、检验溶液中是否含有SO42-时,先加氯化钡溶液后,再加稀盐酸酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 1000°C |
| ═ |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
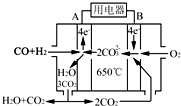 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al和Mg |
| B、Mg和Zn |
| C、Al和Fe |
| D、Fe和Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、转化的物质A有a mol | ||
B、起始时刻和达平衡时容器中的压强比为(1+n):(1+n-
| ||
| C、当υ正(A)=2υ逆(C)时,可判断反应达平衡 | ||
D、物质B的转化率为
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com