
【题目】请完成下列填空:
(1)当SO2和SO3中分子个数比为1:1 时,原子总数之比为____,质量之比为____。
(2)将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度是______。
(3)中和含0.2molHCl的稀盐酸,需NaOH的物质的量为_______;如改用KOH,则所需KOH的质量为________。
【答案】3:4 4:5 ![]() 0.2mol 11.2g
0.2mol 11.2g
【解析】
(1)根据n=![]() =
=![]() 结合分子组成计算;
结合分子组成计算;
(2)根据溶液稀释前后溶质的物质的量不变计算;
(3)根据反应H++OH-=H2O计算。
(1)1个SO2分子中含有3个原子,1个SO3分子中含有4个原子,当SO2和SO3中分子个数比为1∶1时,原子总数之比为3∶4,根据n=![]() =
=![]() 可知,分子数相同时,物质的量相同,则质量与摩尔质量成正比,即质量之比为64∶80=4∶5,故答案为:3∶4;4∶5;
可知,分子数相同时,物质的量相同,则质量与摩尔质量成正比,即质量之比为64∶80=4∶5,故答案为:3∶4;4∶5;
(2)5mol/L的Mg(NO3)2溶液中:c(NO3-)=2c(Mg(NO3)2)=10mol/L,将5mol/L的Mg(NO3)2溶液amL稀释至bmL,则有10mol/L×a×10-3L=c'(NO3-)×b×10-3L,稀释后溶液中NO3-的物质的量浓度是c'(NO3-)=![]() mol/L,故答案为:
mol/L,故答案为:![]() mol/L;
mol/L;
(3)由反应H++OH-=H2O可知,n(NaOH)=n(HCl)=0.2mol;n(KOH)=n(HCl)=0.2mol,m(KOH)=0.2mol×56g/mol=11.2g,故答案为:0.2mol;11.2g。


科目:高中化学 来源: 题型:
【题目】某实验兴趣小组利用易拉罐(主要成分是Al、Fe)制备明矾的过程如下图所示:

⑴ 写出“反应Ⅰ”时的离子反应方程式:________。
⑵ 写出“反应Ⅱ”时的化学反应方程式:________。
⑶ 过滤所得Al(OH)3需进行洗涤,检验Al(OH)3已洗涤干净的方法是:________。
⑷ 明矾能够净水的原因是________。
⑸ Fe和水蒸气在高温下反应后所得固体产物X可用于制取FeCl2溶液。请从下列试剂中选择合适的将X转化为FeCl2溶液。试剂:盐酸、NaCl溶液、Cu粉、Fe粉。依次选用的试剂为:________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25 ℃,0.01 mol/L的v溶液中:  = 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是
= 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是

A. 简单离子半径:W>Y>Z>X
B. W,Y分別与X元素形成的简单化合物的沸点: Y> W
C. Z2Y和ZX都只存在离子键
D. v能抑制水的电离,u能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时有甲、乙、丙三种溶液,甲为0.1mol·L-1NaOH溶液,乙为0.1mol·L-1HCl溶液,丙为0.1 mol·L-1CH3COOH溶液,请回答下列问题:
(1)甲溶液的pH=___________________。
(2)乙溶液中由水电离出的c(H+)=___________________mol·L-1。
(3)写出丙的电离方程式_________________________________________________________,其电离平衡常数表达式Ka=___________________。
(4)向丙中加入乙,会_____________(“抑制”或“促进”)丙的电离,c(H+)_____________(填“增大”、“减小”或“不变”), 丙的电离平衡常数Ka_____________(填“增大”、“减小”或“不变”)。
(5)各取25 mL的乙、丙两溶液,分别用甲中和至pH=7,则消耗甲的体积大小关系为V(乙) ____________V (丙)(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某工业生产过程。

溶解度表:
温度℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
氯化铵 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 55.2 | 65.6 | 71.3 | 77.3 |
硫酸铵 | 70.6 | 73 | 75.4 | 78 | 81 | 88 | 95 | 98 | 103 |
硫酸钾 | 7.4 | 9.3 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 22.9 | 24.1 |
氯化钾 | 28 | 31.2 | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 53.9 | 56.3 |
(1)本工业生产过程的目标产品是____________________________________。(写化学式)
(2)过滤Ⅰ操作所得固体中,除CaCO3外还有一种物质,该固体的用途有_________(试举一例)。
(3)根据溶解度表转化Ⅱ适宜的温度是________
A、0~10℃ B、20~30℃ C、40~60℃ D、90~100℃
过滤Ⅱ操作所得滤渣是__________。
(4)我国著名的化学家也利用了转化Ⅱ的反应原理制备了一种重要的碱,该制备的化学反应方程式为:___________________________________________________
(5)氯化钙结晶水合物(CaCl2·6H2O)进行脱水处理可制得常用的干燥剂,根据下图选择最佳脱水的方法是__________

A、氯化氢气流中加热到174℃ B、直接加热至174℃
C、直接加热至260℃ D、氯化氢气流中加热到260℃
(6)上述工业流程实现了绿色化学的理念,其中__________________(填化学式)实现了循环利用,副产品_________________________(填化学式)可转化为原料,整个流程基本实现了污染物零排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售盐酸试剂瓶标签上的部分信息如下:
盐酸
分子式:HCl
相对分子质量:36.5
密度约1.18gmL-1
HCl的质量分数:36.5%
(1)该盐酸的物质的量浓度为_________ mol·L-1。
(2)取该盐酸50 mL加水稀释到500 mL,则稀释后溶液中c(HCl)=_____mol·L-1。
(3)取稀释后的适量盐酸与足量的锌粒作用,生成0.25 mol氢气,在标准状况下气体的体积____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是地球上最常见的物质之一,是所有生命生存的重要资源。
(1)![]() 键和
键和![]() 键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为________;水溶液中存在H3O+离子,写出该微粒的结构式________(标出配位键)。
键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为________;水溶液中存在H3O+离子,写出该微粒的结构式________(标出配位键)。
(2)科学家发现在特殊条件下,水能表现出许多种有趣的结构和性质
①一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如下:
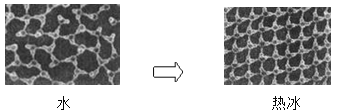
使水结成“热冰”采用“弱电场”的条件,说明水分子是______分子。下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用力类型完全相同的是______。
A.固态氨 B.食盐 C.干冰 D.金刚石
②用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。产生的阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式__________;该阳离子还能与水作用生成羟基,经测定此时的水具有酸性,写出该过程的离子方程式____________________。
(3)水的性质中的一些特殊现象对于生命的存在意义非凡,请解释水的分解温度远高于其沸点的原因______________________;试从结构的角度分析固态水(冰)的密度小于液态水的密度的原因是___________________________。
(4)甲烷的气体水合物晶体称为可燃冰,存在于海底和冰川底部,是巨大的潜在能源。在可燃冰晶体中,甲烷分子装在水分子构成的笼内,假设可燃冰晶体中的水笼里装的都是甲烷,理想的可燃冰晶胞组成为8CH4·46H2O,X-射线衍射分析表明,可燃冰晶体属于立方晶体,晶胞参数a=1200pm。则该晶体的密度为________g/cm3(计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ/mol; CO(g)+
O2(g)=CO(g) ΔH=-110.5 kJ/mol; CO(g)+![]() O2(g)=CO2(g) ΔH=-283 kJ/mol,在36 g碳不完全燃烧所得气体中,CO占
O2(g)=CO2(g) ΔH=-283 kJ/mol,在36 g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积,且与这些碳完全燃烧相比,损失的热量是
体积,且与这些碳完全燃烧相比,损失的热量是
A. 172.5 kJB. 283 kJC. 566 kJD. 1149 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com