
【题目】工业常用燃料与水蒸气反应制备H2和CO,再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)CO(g)+H2(g)△H=+131.4kJmol-1,下列判断正确的是_______。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)C(s)+H2O(1)△H=﹣QkJmol-1,则Q<131.4
d.若C(s)+CO2(g)2CO(g)△H1;CO(g)+H2O(g)H2(g)+CO2(g)△H2则:△H1+△H2=+131.4kJmol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)CO(g)+3H2(g)。已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
不同时间各物质的物质的量/mol | ||||
0min | 2min | 4min | 6min | |
CH4 | 2.00 | 1.76 | 1.60 | n2 |
H2 | 0.00 | 0.72 | n1 | 1.20 |
根据表中数据计算:
①0min~2min 内H2的平均反应速率为_____________________。
②达平衡时,CH4的转化率为_____________;在上述平衡体系中再充入2.00mol甲烷1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比___________(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有__________(填字母)。
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变 d.3υ正(CH4)=υ逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过):
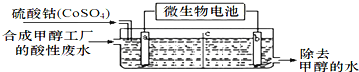
①a电极的名称为__________。
②写出除去甲醇的离子方程式______________________。
③微生物电池是绿色酸性料电池,写出该电池正极的电极反应式为__________________。
【答案】ad 0.18mol·L﹣1·min﹣1 20% 变小 ad 阳极 6Co3++CH3OH+H2O=6Co2++CO2↑+6H+ O2+4e-+4H+=2H2O
【解析】
(1)a、反应是吸热反应,生成物能量总和大于反应物能量总和,故a正确;
b、上述反应生成1mol H2时吸收131.4 kJ的热量,故b错误;
c、根据“C(s)+H2O(g)CO(g)+H2(g)H=+131.4kJmol-1”,CO(g)+H2(g)C(s)+H2O(g)△H=﹣131.4kJmol-1,H2O(g)→H2O(l)放出热量,则CO(g)+H2(g)C(s)+H2O(1)△H=﹣QkJmol-1,Q>131.4,故c错误;
d、若C(s) + CO2(g) 2CO(g) △H1;CO(g) + H2O(g) H2(g) + CO2(g) △H2,根据盖斯定律,则:△H1 + △H2 =+131.4 kJmol-1,故d正确;
答案选ad。
(2)①0min~2min 内H2的平均反应速率为![]() =0.18mol·L﹣1·min﹣1;
=0.18mol·L﹣1·min﹣1;
②4min时,参加反应的甲烷为2mol﹣1.6mol=0.4mol,生成氢气为0.4mol×3=1.2mol,与6min时相等,说明4min时反应已经达到平衡,此时甲烷的转化率为![]() ×100%=20%;在上述平衡体系中再充入2.00mol甲烷和1.00mol 水蒸气,相当于增大压强,平衡向逆反应方向移动,达到新平衡时H2的体积分数与原平衡相比变小;
×100%=20%;在上述平衡体系中再充入2.00mol甲烷和1.00mol 水蒸气,相当于增大压强,平衡向逆反应方向移动,达到新平衡时H2的体积分数与原平衡相比变小;
a.CO的含量保持不变,反应达到平衡;
b.容器中c(CH4)与c(CO)相等,不一定平衡;
c.容器中混合气体的密度一直不变,不是平衡状态的标志;
d.3υ正(CH4)=υ逆(H2),是反应达到平衡的本质标志;
答案选ad。
(3)①电极a,Co2+被氧化成Co3+,发生氧化反应,为电解池的阳极;
②甲醇被氧化生成二氧化碳,Co3+被还原生成Co2+,溶液呈酸性,则生成物中含有氢离子,所以该反应离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
③微生物电池是绿色酸性燃料电池,氧气在正极发生得电子的还原反应,正极的电极反应式为4H++O2+4e-=2H2O。


科目:高中化学 来源: 题型:
【题目】钠离子电池具有成本低、能量转换效率高、寿命长等优点。一种钠离子电池用碳基材料 (NamCn)作负极,利用钠离子在正负极之间嵌脱过程实现充放电,该钠离子电池的工作原理 为Na1-mCoO2+NamCn![]() NaCoO2+Cn。下列说法不正确的是
NaCoO2+Cn。下列说法不正确的是
A.放电时,Na+向正极移动
B.放电时,负极的电极反应式为NamCn—me-=mNa++Cn
C.充电时,阴极质量减小
D.充电时,阳极的电极反应式为NaCoO2-me-=Na1-mCoO2+mNa+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们发现氧化铁硫杆菌能促使黄铁矿(FeS2)氧化成硫酸铁和硫酸,氧化铁硫杆菌能把矿物中的硫或硫化物氧化成硫酸,而硫酸和硫酸铁能将某些矿石中的金属元素转化成金属硫酸盐,从而开辟了“细菌冶金”的先河。氧化铁硫杆菌的活动过程如图所示,其中a过程发生的反应为4FeS2+15O2+2H2O![]() 2Fe2(SO4)3+2H2SO4。则下列说法错误的是
2Fe2(SO4)3+2H2SO4。则下列说法错误的是

A.a过程中释放能量
B.细菌在反应a过程中起了催化剂的作用
C.b过程类似于植物的光合作用,细菌将能量储存在C6H12O6中
D.有些细菌可直接把含铅、汞等重金属的矿石溶解,得到重金属离子的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组利用如图装置来制备无水AlCl3(已知:无水AlCl3178℃升华,遇水能迅速发生反应)。下列说法正确的是( )
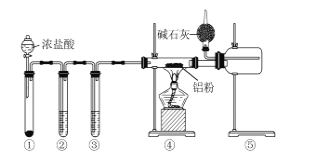
A.装置①中的试剂可能是二氧化锰
B.装置②、③中的试剂分别为浓硫酸、饱和食盐水
C.④和⑤之间使用粗玻璃管是为了防堵塞
D.球形干燥管中碱石灰的作用只有处理尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
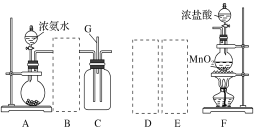
请回答下列问题:
(1)装置A中的烧瓶内固体可选用________(填字母)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(2)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
备选装置 | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
B:________、D:________、E:________。
(3)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:_______
(4)装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案确定该白色固体中的阳离子:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学能与其他能量相互转化的说法错误的是( )
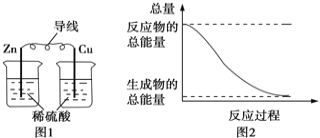
A.图1所示的装置能将化学能转变为电能
B.图2所示的反应为放热反应
C.中和反应中,生成物的总能量比反应物的总能量低
D.化学反应中能量变化的主要原因是化学键的断裂与形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中常见电动自行车主要部件之铅蓄电池:PbO2+2H2SO4+Pb![]() PbSO4+H2O。有关说法不正确的是( )
PbSO4+H2O。有关说法不正确的是( )
A.该电池充电过程中电解质溶液pH值减小
B.该电池放电过程中将化学能转化为电能
C.放电过程中,电子由Pb电极经过导线流向PbO2
D.铅蓄电池放电过程中负极电极反应式为:Pb -2e-=Pb2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g)Si(s)+4HCl(g)﹣236kJ
(1)反应涉及的元素原子半径从大到小的排列顺序为_____。其中硅原子最外层有_____个未成对电子,有_____种不同运动状态的电子;
(2)反应涉及的化合物中,写出属于非极性分子的结构式:_____;产物中晶体硅的熔点远高HCl,原因是_____;
(3)氯和硫是同一周期元素,写出一个能比较氯和硫非金属性强弱的化学方程式:_____;
(4)在一定温度下进行上述反应,若反应容器的容积为2L,3分钟后达到平衡,测得气体质量减小8.4g,则在3分钟内H2的平均反应速率为_____;
(5)该反应的平衡常数表达式K=_____,可以通过_____使K增大;
(6)一定条件下,在密闭恒容器中,能表示上述反应一定达到化学平衡状态的是_____。
a.v逆(SiCl4)=2v正(H2)
b.固体质量保持不变
c.混合气体密度保持不变
d.c(SiCl4):c(H2):c(HCl)=1:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核能的和平利用对于完成“节能减排”的目标有着非常重要的意义。尤其是核聚变,因其释放能量大,无污染,成为当前研究的一个热门课题。其反应原理为![]() +
+![]() →
→![]() +
+![]() 。下列说法中正确的是( )
。下列说法中正确的是( )
A.D和T是质量数不同,质子数相同的氢的两种元素
B.通常所说的氢元素是指![]()
C.![]() 、
、![]() 、
、![]() 是氢的三种核素,互为同位素
是氢的三种核素,互为同位素
D.这个反应既是核反应,也是化学反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com