
 原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题:分析 原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,则X为H元素;Y原子基态时最外层电子数是其内层电子总数的2倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故Y为C元素;Z原子基态时2p原子轨道上有3个未成对电子,原子核外电子排布为1s22s22p6,则Z为N元素;W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构,原子核外电子数为2+8+18+1=29,故W为Cu.
(1)W为Cu,处于的第四周期IB族;C2H2分子结构简式为H-C≡C-H;碳原子杂化轨道数目俄日2;
(2)NH3分子之间形成氢键,沸点比化合物CH4的高;
(3)原子数目相等、价电子总数也相等的微粒互为等电子体;
每个碳原子周围有一个碳碳双键和两个碳碳单键,均为两个碳原子共用,所以每个碳实际占有的碳碳双键数为0.5,而每个双键中有1个σ键、1个π键;
计算36g C60的物质的量,结合分子含有30个C=C双键计算吸收氢气的体积;
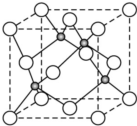
(4)晶胞中黑色球数目为4,白色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故Cu、Cl原子数目之比为1:1,可以确定化学式,Cu与Cl原子配位数相等;该氯化物与浓盐酸发生非氧化还原反应,生成配合物HnCuCl3,根据化合价代数和为0可知n=1,进而书写反应方程式.
解答 解:原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,则X为H元素;Y原子基态时最外层电子数是其内层电子总数的2倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故Y为C元素;Z原子基态时2p原子轨道上有3个未成对电子,原子核外电子排布为1s22s22p6,则Z为N元素;W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构,原子核外电子数为2+8+18+1=29,故W为Cu.
(1)W为Cu,原子核外电子数为29,处于的第四周期IB族,基态原子的价电子排布式为:3d104s1 ,C2H2分子结构简式为H-C≡C-H,C原子形成2个σ键,没有孤对电子,杂化轨道数目为2,碳原子采取sp杂化,
故答案为:3d104s1 ;sp;
(2)NH3分子之间形成氢键,沸点比化合物CH4的高,
故答案为:NH3分子间存在氢键;
(3)元素碳的一种氧化物与元素氮的一种氧化物互为等电子体,为CO2与N2O,元素Z的这种氧化物的分子式是 N2O,
C60分子结构为球形32面体,它是由60个Y原子以20个六元环和12个五元环连接而成的具有30个C=C键的足球状空心对称分子,每个碳原子周围有一个碳碳双键和两个碳碳单键,均为两个碳原子共用,所以每个碳实际占有的碳碳双键数为0.5,而每个双键中有1个σ键、1个π键,故该分子中σ键和π键的个数比3:1,36g C60的物质的量为$\frac{36g}{720g/mol}$=0.05mol,含有碳碳双键为0.05mol×30=1.5mol,最多可以吸收标准状况下的氢气为1.5mol×22.4L/mol=33.6L.
故答案为:N2O;3:1;33.6;
(4)晶胞中黑色球数目为4,白色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故Cu、Cl原子数目之比为1:1,则该氯化物的化学式是CuCl,黑色球配位数为4,则白色球配位数也是4,故该晶体中Cu的配位数为4,它可与浓盐酸发生非氧化还原反应,生成配合物HnCuCl3,根据化合价代数和为0可知n=1,反应的化学方程式为:CuCl+2HCl═H2CuCl3,
故答案为:CuCl;4;CuCl+2HCl═H2CuCl3.
点评 本题以元素推断为载体,综合考查物质结构与性质,涉及核外电子排布规律、杂化轨道、氢键、等电子体、晶胞结构与计算等,注意利用均摊法进行晶胞计算,需要学生具备扎实的基础与综合运用能力.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该锂电池在放电过程中,Li+从正极区向负极区迁移 | |
| B. | 电解质溶液中混入水,对电池反应无影响 | |
| C. | 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 | |
| D. | 电池工作过程中,金属锂提供的电子与正极生成硫的物质的量之比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
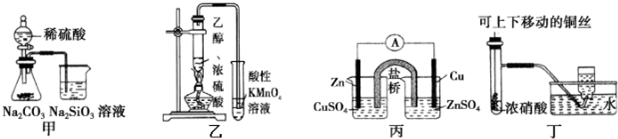
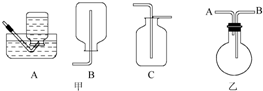
| A. | 图甲证明非金属性强弱:S>C>Si | |
| B. | 装置乙可用于检验有乙烯生成 | |
| C. | 图丙构成铜锌原电池,产生持续稳定的电流 | |
| D. | 图丁可制备并收集NO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钾处理水的原理与明矾完全相同 | |
| B. | 推广煤的气化和液化技术,能减少二氧化碳的排放 | |
| C. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆属于新型无机非金属材料 | |
| D. | 食品安全包括限制添加剂的种类和添加的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下1L 0.1 mol•L-1的FeSO4溶液中含有0.4NA个氧原子 | |
| B. | 用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L | |
| C. | 1.2g CaCO3与Mg3N2的混合物中含有质子数为0.6NA | |
| D. | 常温下,pH=7的0.5 mol﹒L-1的CH3COONH4溶液中,NH4+浓度为0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验方案 | A | B | C | D |
| 图 | 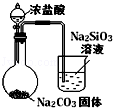 | 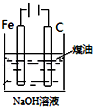 | 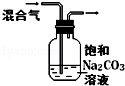 | 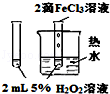 |
| 实验目的 | 比较HCl、H2CO3和H2SiO3的酸性强弱 | 制备Fe(OH)2并能较长时间观察其颜色 | 除去CO2气体中混有的SO2 | 验证FeCl3对H2O2分解反应有催化作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g重水(D2O)中含NA个中子 | |
| B. | 8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA | |
| C. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| D. | 标准状况下,密度为d g/L的某气体纯净物一个分子的质量为$\frac{22.4d}{{N}_{A}}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com