
|
| |
| [ ] | |
A. |
1 |
B. |
2 |
C. |
3 |
D. |
4 |
科目:高中化学 来源: 题型:阅读理解
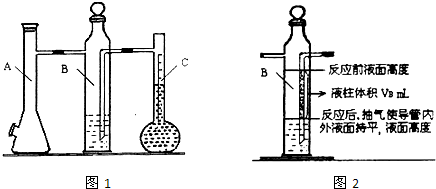
| 实验次数 | m(Mg)/g | 硫酸体积/mL | 液体量瓶中液体体积/mL | 抽出气体体积/mL | 氢气体积/mL | 计算1mol氢体积/L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | X | |
| 2 | 0.115 | 10.0 | 121.0 | 8.0 |
| 实验次数 | m(Mg) g |
硫酸体积mL | 液体量瓶中液体体积mL | 抽出气体体积mL | B瓶的一段液柱体积mL | 水汽体积百分含量 | 计算1mol氢体积L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | VB | a% |
查看答案和解析>>
科目:高中化学 来源:潮阳一中2007届高三化学第二次月考(人教) 人教 题型:058
在长期载人太空飞行的宇航器中,每个宇航员平均每天需要消耗0.9kg氧气,呼出1.0kg的二氧化碳。为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的科学探索。方法一:有的科学家提出“金属过氧化物处理系统”,即不断的将座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。有关反应的化学方程式为:①________②________;将处理后的气体充入座舱时,应注意采取的一项措施是________
方法二:有的科学家根据电解原理设计了飞船内空气更新实验系统,该系统结构示意图如下:

(1)管道①把飞船座舱内含有较多二氧化碳的潮湿的空气通入“电化学二氧化碳处理系统”的N极室,通过该电极反应可以使二氧化碳不断被吸收;该电极反应式为________
其电解产物吸收二氧化碳的离子反应方程式为________。在N极吸收二氧化碳后形成的离子会通过隔膜进入M极室,通过M极的电极反应可以使二氧化碳从电解液中释放出来,并保持系统的pH不变;该电极反应式为________、________。
(2)管道②是将处理后的空气混入“电解水系统”产生的新鲜氧气,然后通入飞船座舱内供宇航员呼吸用。在“电解水系统”中Y为________极(填“阴”或“阳”)X极的电极反应为________
(3)逸出的二氧化碳没有排出飞船外,而是通过管道③进入“二氧化碳还原系统”。在该系统内,二氧化碳跟氢气在一定条件下反应,其产物中有甲烷等气体,请评价这种处理的意义________
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com