
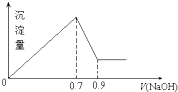
 现有MgCl2和Al2(SO4)3混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为 ( )
现有MgCl2和Al2(SO4)3混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为 ( )| A、1:3 | B、2:3 |
| C、6:1 | D、3:1 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
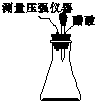 某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.| 编号 | 实验目的 | 炭粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
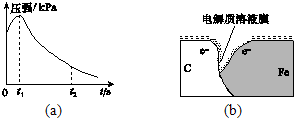 (3)该小组对图(a)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
(3)该小组对图(a)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:查看答案和解析>>
科目:高中化学 来源: 题型:
| 不纯物(少量杂质) | 除杂试剂 | 分离方法 | |
| A | 福尔马林(蚁酸) | 饱和碳酸钠溶液 | 蒸馏 |
| B | 高级脂肪酸钠(甘油) | NaCl固体 | 蒸馏 |
| C | 乙酸乙酯(乙醇) | 氢氧化钠溶液 | 分液 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解、过滤、蒸发、洗涤 |
| B、溶解、过滤、洗涤、干燥 |
| C、溶解、蒸发、洗涤、过滤 |
| D、溶解、洗涤、过滤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
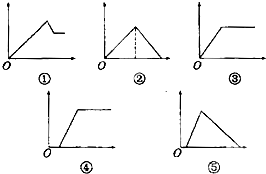 下列图象中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,按题意将相应的图象序号与(1)-(5)相对应的顺序是( )
下列图象中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,按题意将相应的图象序号与(1)-(5)相对应的顺序是( )| 溶液 | 加入物质 |
| (1)饱和石灰水 | 通入过量CO2气体 |
| (2)氯化铝溶液 | 加入过量氨水 |
| (3)MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 |
| (4)含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 |
| (5)含少量NaOH的NaAlO2溶液 | 通入过量CO2气体 |
| A、①③②④⑤ |
| B、③⑤④②① |
| C、①②③④⑤ |
| D、②③①⑤④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CH3COO-)>c(Na+) |
| B、c(CH3COOH)>c(CH3COO-) |
| C、c(H+)<c(OH-) |
| D、c(CH3COO-)>+c(CH3COOH)=0.02mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大压强 | B、减小压强 |
| C、减少E的浓度 | D、降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com