
| A. | 硅是良好的半导体材料 | |
| B. | 氨气与硝酸合成氮肥属于人工固氮 | |
| C. | 金刚石、石墨和富勒烯互为同素异形体 | |
| D. | 硬铝、青铜和不锈钢都属于合金 |
分析 A、硅是半导体;
B、固氮应为氮气生成化合物;
C、金刚石、石墨和富勒烯是碳元素形成的不同种单质;
D、依据青铜、硬铝、不锈钢的成分和合金的概念分析判断.
解答 解:A、硅是半导体,所以硅是良好的半导体材料,故A正确;
B、固氮应为氮气生成化合物,所以氨气与硝酸合成氮肥不属于人工固氮,故B错误;
C、金刚石、石墨和富勒烯是碳元素形成的不同种单质,互称为同素异形体,故C正确;
D、青铜是铜锡合金、硬铝是铝硅、镁等形成的合金、不锈钢是铁铬、镍合金,故D正确;
故选B.
点评 本题主要考硅、固氮和同素异形体,侧重考查了铝合金,解答时要充分理解各种物质的性质,然后再根据物质的性质方面进行分析、判断,从而确定物质的用途,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 明矾净水:Al3++3H2O∧Al(OH)3+3H+ | |
| B. | 氯气通入水中:Cl2+H2O?2H++ClO-+Cl- | |
| C. | 铜和硝酸银溶液反应:Cu+2Ag+═Cu2++2Ag | |
| D. | 稀硫酸与氢氧化钡溶液反应:Ba2++OH-+H++SO42-═H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的电子式: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 尿素[CO(NH2)2]是一种有机物 | D. | 聚丙烯的化学式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质.
短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中,非金属单质一定被还原 | |
| B. | 由H2O2→O2的过程一定需加入氧化剂才能实现 | |
| C. | 置换反应都属于氧化还原反应,反应物中的单质一定作还原剂 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使品红、酸性高锰酸钾溶液褪色,分别体现了它的漂白性和还原性 | |
| B. | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,说明Fe(NO3)2样品已经变质 | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加盐酸,沉淀不溶解,说明该溶液中一定存在SO42- | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(正)增大,v(逆)减小 | B. | v(正)减小,v(逆)增大 | ||
| C. | v(正)、v(逆)不同程度增大 | D. | v(正)、v(逆)同等程度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
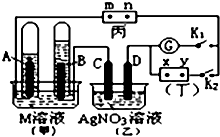 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com