
Ö÷×å ÖÜĘŚ | ¢ńA | ¢ņA | ¢óA | ¢ōA | ¢õA | ¢öA | ¢÷A | 0 |
| 2 | ¢Ł | ¢Ś | ¢Ū | |||||
| 3 | ¢Ü | ¢Ż | ¢Ž | ¢ß | ¢ą | |||
| 4 | ¢į | ¢ā |
 £®
£® £®
£®·ÖĪö ÓÉŌŖĖŲŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆæÉÖŖ£¬¢ŁĪŖC£¬¢ŚĪŖN£¬¢ŪĪŖF£¬¢ÜĪŖMg£¬¢ŻĪŖAl£¬¢ŽĪŖS£¬¢ßĪŖCl£¬¢ąĪŖAr£¬¢įĪŖK£¬¢āĪŖBr£®
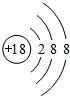
£Ø1£©Ļ”ÓŠĘųĢåAr»ÆѧŠŌÖŹ×ī²»»īĘĆ£¬Ō×ÓŗĖĶāÓŠ18øöµē×Ó£¬ø÷²ćµē×ÓŹ½ĪŖ2”¢8”¢8£»
£Ø2£©ÄÜŠĪ³ÉĮ½ŠŌĒāŃõ»ÆĪļµÄŌŖĖŲĪŖAl£»øĆŌŖĖŲµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļĪŖAl£ØOH£©3£¬¢į×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļĪŖKOH£¬¶žÕß·“Ӧɜ³ÉĘ«ĀĮĖį¼ŲÓėĖ®£»
£Ø3£©±ķŹ¾¢ÜŌŖĖŲÓė¢ßŌŖĖŲŠĪ³É»ÆŗĻĪļMgCl2£¬ÓÉĆ¾Ąė×ÓÓėĀČĄė×Ó¹¹³É£»
£Ø4£©ŌŖĖŲµÄ·Ē½šŹōŠŌŌ½Ē棬×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļĖįŠŌŌ½Ē棻
£Ø5£©Ķ¬ÖÜĘŚ×Ō×ó¶ųÓŅ½šŹōŠŌ¼õČõ£¬øł¾ŻÓėĖ®»ņĖį·“Ó¦µÄÄŃŅ×”¢¾ēĮŅ³Ģ¶ČŅŌ¼°×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄ¼īŠŌĒæČõµČÅŠ¶Ļ½šŹōŠŌĒæČõ£»
£Ø6£©ŌŖĖŲµÄ·Ē½šŹōŠŌŌ½Ē棬ŅõĄė×Ó»¹ŌŠŌŌ½Čõ£¬ĄūÓƵ„ÖŹÖ®¼äµÄĻą»„ÖĆ»»·“Ó¦æÉŅŌÖ¤Ć÷£»
£Ø7£©HF·Ö×ÓÖ®¼ä“ęŌŚĒā¼ü£¬HCl”¢HBr·Ö×ÓÖ®¼äĪŖ·¶µĀ»ŖĮ¦£¬¹ŹHF·Šµć×īøߣ¬Ļą¶Ō·Ö×ÓÖŹĮæŌ½“󣬷¶µĀ»ŖĮ¦Ō½Ē棬½āĢāµÄ·ŠµćŌ½øߣ»·Ē½šŹōŠŌŌ½Ē棬Ēā»ÆĪļŌ½ĪČ¶ØŠŌ£¬ŌŚČÜŅŗÖŠ²»Ņ×µēĄė£¬ĖįŠŌŌ½Čõ£®
½ā“š ½ā£ŗÓÉŌŖĖŲŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆæÉÖŖ£¬¢ŁĪŖC£¬¢ŚĪŖN£¬¢ŪĪŖF£¬¢ÜĪŖMg£¬¢ŻĪŖAl£¬¢ŽĪŖS£¬¢ßĪŖCl£¬¢ąĪŖAr£¬¢įĪŖK£¬¢āĪŖBr£®
£Ø1£©Ļ”ÓŠĘųĢåAr»ÆѧŠŌÖŹ×ī²»»īĘĆ£¬Ō×ÓŗĖĶāÓŠ18øöµē×Ó£¬ø÷²ćµē×ÓŹ½ĪŖ2”¢8”¢8£¬Ō×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ £»
£»
£Ø2£©ÄÜŠĪ³ÉĮ½ŠŌĒāŃõ»ÆĪļµÄŌŖĖŲĪŖAl£¬“¦ÓŚÖÜĘŚ±ķÖŠµŚČżÖÜĘŚµŚ¢óA×壻øĆŌŖĖŲµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļĪŖAl£ØOH£©3£¬¢į×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļĪŖKOH£¬¶žÕß·“Ӧɜ³ÉĘ«ĀĮĖį¼ŲÓėĖ®£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗKOH+Al£ØOH£©3ØTKAlO2+2H2O£¬
¹Ź“š°øĪŖ£ŗµŚČżÖÜĘŚµŚ¢óA×壻KOH+Al£ØOH£©3ØTKAlO2+2H2O£»
£Ø3£©±ķŹ¾¢ÜŌŖĖŲÓė¢ßŌŖĖŲŠĪ³É»ÆŗĻĪļMgCl2£¬ÓÉĆ¾Ąė×ÓÓėĀČĄė×Ó¹¹³É£¬ÓƵē×ÓŹ½±ķŹ¾ŠĪ³É¹ż³ĢĪŖ£ŗ £¬
£¬
¹Ź“š°øĪŖ£ŗ £»
£»
£Ø4£©×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļÖŠĖįŠŌ×īĒæµÄŹĒHClO4£¬
¹Ź“š°øĪŖ£ŗHClO4£»
£Ø5£©Ķ¬ÖÜĘŚ×Ō×ó¶ųÓŅ½šŹōŠŌ¼õČõ£¬¹ŹMgµÄ½šŹōŠŌøüĒ棻
a£®Mg”¢AlĮ½ÖÖŌŖĖŲŌŚæÕĘųÖŠ¾ĆÖĆ£¬½šŹō±ķĆęÓŠŃõ»ÆĪļĤ£¬·Ö±š·ÅČėČČĖ®ÖŠ£¬²»ÄÜøł¾Ż·“ӦŊ¶Ļ½šŹōŠŌĒæČõ£¬¹Źa“ķĪó£»
b£®½«ŠĪד”¢“óŠ”ĻąĶ¬µÄÕāĮ½ÖÖŌŖĖŲµÄµ„ÖŹ·Ö±šŗĶĶ¬ÅØ¶ČµÄŃĪĖį·“Ó¦£¬·“Ó¦Ō½¾ēĮŅ£¬ĖµĆ÷½šŹōŠŌŌ½Ē棬¹ŹbÕżČ·£»
c£®½«ŠĪד”¢“óŠ”ĻąĶ¬ÕāĮ½ÖÖŌŖĖŲµÄµ„ÖŹ·Ö±šŗĶČČĖ®×÷ÓĆ£¬²¢µĪČė·ÓĢŖČÜŅŗ£¬ČÜŅŗ¼īŠŌŌ½Ē棬ĖµĆ÷½šŹōŠŌŌ½Ē棬¹ŹcÕżČ·£»
d£®¶žÕ߶¼ŹĒ½šŹō£¬Ć»ÓŠĘųĢ¬Ēā»ÆĪļ£¬²»ÄÜ±Č½ĻĒā»ÆĪļµÄĪČ¶ØŠŌÅŠ¶Ļ½šŹōŠŌĒæČõ£¬¹Źd“ķĪó£»
¹ŹŃ”bc£®
£Ø6£©·Ē½šŹōŠŌS£¼Cl£¬ŌŖĖŲµÄ·Ē½šŹōŠŌŌ½Ē棬ŅõĄė×Ó»¹ŌŠŌŌ½Čõ£¬¹ŹS2-µÄ»¹ŌŠŌ½ĻĒ棬ĄūÓƵ„ÖŹÖ®¼äµÄĻą»„ÖĆ»»·“Ó¦æÉŅŌÖ¤Ć÷£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ£¬
¹Ź“š°øĪŖ£ŗS2-£»
£Ø7£©HF·Ö×ÓÖ®¼ä“ęŌŚĒā¼ü£¬HCl”¢HBr·Ö×ÓÖ®¼äĪŖ·¶µĀ»ŖĮ¦£¬¹ŹHF·Šµć×īøߣ¬Ļą¶Ō·Ö×ÓÖŹĮæŌ½“󣬷¶µĀ»ŖĮ¦Ō½Ē棬¾§ĢåµÄ·ŠµćŌ½øߣ¬¹Ź·ŠµćHF£¾HBr£¾HCl£»·Ē½šŹōŠŌŌ½Ē棬Ēā»ÆĪļŌ½ĪČ¶ØŠŌ£¬ŌŚČÜŅŗÖŠ²»Ņ×µēĄė£¬ĖįŠŌŌ½Čõ£¬Ēā»ÆĪļĖįŠŌÓÉČõµ½ĒæµÄĖ³Šņ£ŗHF£¼HCl£¼HBr£¬
¹Ź“š°øĪŖ£ŗHF£¾HBr£¾HCl£»HF£¼HCl£¼HBr£®
µćĘĄ ±¾Ģāæ¼²éŌŖĖŲÖÜĘŚ±ķÓėŌŖĖŲÖÜĘŚĀÉ×ŪŗĻŌĖÓĆ£¬ÄŃ¶Č²»“ó£¬×¢ŅāÕūĢå°ŃĪÕŌŖĖŲÖÜĘŚ±ķÓė»ł“”ÖŖŹ¶µÄÕĘĪÕ£¬×¢Ņā½šŹōŠŌ”¢·Ē½šŹōĒæČõ±Č½ĻŹµŃéŹĀŹµ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | KµÄŌ×Ó½į¹¹Ź¾ŅāĶ¼ 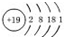 | B£® | CO2µÄ½į¹¹Ź½ O-C-O | ||
| C£® | C-12Ō×ӵıķŹ¾·½·Ø£ŗC612 | D£® | NH4ClµÄµē×ÓŹ½£ŗ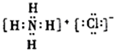 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ć¾µÄ½šŹōŠŌ±ČĀĮČõ | |
| B£® | Ć¾ŗĶĀĮµÄŃõ»ÆĪļ¶¼æÉŅŌÓėŃĪĖį·“Ó¦ | |
| C£® | Ć¾ŗĶĀĮŌ×ÓµÄ×īĶā²ćµē×ÓŹż¶¼ĪŖ3 | |
| D£® | Ć¾ŗĶĀĮµÄŃõ»ÆĪļ¶¼æÉŅŌÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓĆĶŠÅĢĢģĘ½³ĘČ”10.60 gµÄNa2CO3¹ĢĢ壬ČÜÓŚ1 LµÄĖ®æÉÅä³É0.1 mol/LµÄČÜŅŗ | |
| B£® | ŹµŃéŹŅÕōĮóŹÆÓĶæÉÓĆČēĶ¼¼×ĖłŹ¾ŹµŃé×°ÖĆ | |
| C£® | Č”ÓĆ½šŹōÄĘ»ņ¼ŲŹ±£¬Ć»ÓĆĶźµÄÄĘ»ņ¼ŲŅŖ·Å»ŲŌĘæ | |
| D£® | ÅäÖĘ500 mL 0.4 mol/L NaClČÜŅŗ£¬±ŲŅŖµÄŅĒĘ÷ČēĶ¼ŅŅĖłŹ¾ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČōĮ½ÕßÖŠÓŠŅ»ÖÖĪŖĒæµē½āÖŹ£¬ŌņŅ»¶ØŹĒBOH | |
| B£® | ČōHAŹĒĒæĖį£¬»ģŗĻŅŗÖŠĄė×ÓÅØ¶Č¹ŲĻµŅ»¶ØŹĒC£ØA-£©£¾C£ØB+£©£¾C£ØHO-£©£¾C£ØH+£© | |
| C£® | Čō»ģŗĻŅŗÖŠ“ęŌŚĄė×ÓĖ®½ā£¬ŌņŅ»¶ØŹĒA-Ė®½ā | |
| D£® | Į½Õß»ģŗĻŗó£¬BOHÓŠæÉÄܹżĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NaOH£Ø¹ĢĢ壩 | B£® | CH3COOH | C£® | NaCl£Ø¹ĢĢ壩 | D£® | CH3COONa£Ø¹ĢĢ壩 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŹµŃé²½Öč | ŹµŃéĻÖĻó |
| ½«“ņÄ„¹żµÄĀĮʬ£Ø¹żĮ棩·ÅČėŅ»¶ØÅØ¶ČµÄCuCl2ÖŠ£® | ²śÉśĘųÅŻ£¬Īö³öŹčĖɵÄŗģÉ«¹ĢĢ壬ČÜŅŗÖš½„±äĪŖĪŽÉ« |
| ·“Ó¦½įŹųŗó·ÖĄė³öČÜŅŗ±øÓĆ |  |
| ŗģÉ«¹ĢĢåÓĆÕōĮóĖ®Ļ“µÓŗó£¬ÖĆÓŚ³±ŹŖæÕĘųÖŠ | Ņ»¶ĪŹ±¼äŗó¹ĢĢåÓÉŗģÉ«±äĪŖĀĢÉ«[ŹÓĘäÖ÷ŅŖ³É·ÖĪŖCu2£ØOH£©2CO3] |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
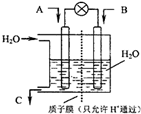 Ćę¶ŌČ«Ēņ½üĘŚµÄĘųŗņŅģ³££¬»·¾³ĪŹĢāŌŁ“Ī³ÉĪŖ½¹µć£®SO2”¢NOx”¢CO2ŹĒ¶Ō»·¾³Ó°Ļģ½Ļ“óµÄĘųĢ壬¶ŌĖūĆĒµÄŗĻĄķæŲÖĘŗĶÖĪĄķŹĒÓÅ»ÆĪŅĆĒÉś“ę»·¾³µÄÓŠŠ§Ķ¾¾¶£®
Ćę¶ŌČ«Ēņ½üĘŚµÄĘųŗņŅģ³££¬»·¾³ĪŹĢāŌŁ“Ī³ÉĪŖ½¹µć£®SO2”¢NOx”¢CO2ŹĒ¶Ō»·¾³Ó°Ļģ½Ļ“óµÄĘųĢ壬¶ŌĖūĆĒµÄŗĻĄķæŲÖĘŗĶÖĪĄķŹĒÓÅ»ÆĪŅĆĒÉś“ę»·¾³µÄÓŠŠ§Ķ¾¾¶£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
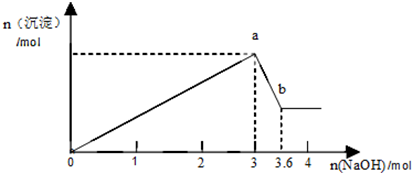
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com