
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
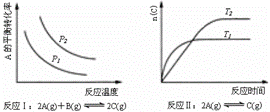
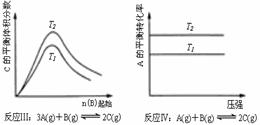
根据以上规律判断,上列结论正确的是( )
A.反应Ⅰ:△H>0,P2>P1 B.反应Ⅱ:△H>0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 D.反应Ⅳ:△H<0,T2>T1
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
从固体混合物A出发可以发生如下框图所示的一系列变化。
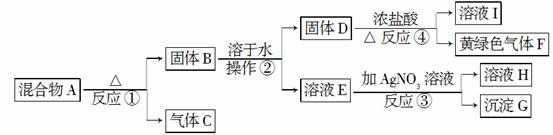
G为不溶于稀硝酸的白色固体;溶液H的焰色反应呈紫色(透过蓝色的钴玻璃观察)。回答下列问题:
(1)在实验室中收集气体C,可选择如图装置中的________。

(2)操作②的名称是________。在操作②中所使用的玻璃仪器的名称是________。在得到固体D时必须进行洗涤、干燥等操作,洗涤固体D的目的是________________________________________。
(3)写出反应①的化学方程式、反应④的离子方程式:
反应①:_____________________________________________,
反应④:___________________________________________。
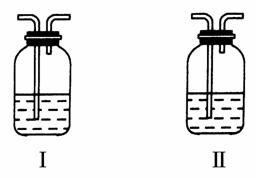
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它依次通过如图中的Ⅰ、Ⅱ装置,其中瓶Ⅰ中盛放的是________,瓶Ⅱ中盛放的是________。
(5)实验中必须吸收多余的气体F,以免污染空气。下图是实验室用NaOH溶液吸收气体F的装置,为防止产生倒吸现象,合理的装置是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的现象描述与离子方程式都正确的是( )
A.金属镁与稀盐酸反应:有气泡逸出:Mg+2H++2Cl-===MgCl2+H2↑
B.氯化钡溶液与稀硫酸反应:有白色沉淀生成:Ba2++SO ===BaSO4↓
===BaSO4↓
C.碳酸钠与盐酸反应:有气泡逸出:Na2CO3+2H+===CO2↑+H2O+2Na+
D.硫酸铜溶液中加入过量的NaOH溶液:有白色沉淀产生:Cu2++2OH-===Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应A(g)+3B(g)  2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
A、v(A)=0.01 mol/(L•s) B、v(B)=0.02 mol/(L•s)
C、v(B)=0.60mol/(L•min) D、v(C)=1.0mol/(L•min)
查看答案和解析>>
科目:高中化学 来源: 题型:
2X+Y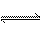 2Z(气) △H<0,温度升高,气体平均相对分子质量减小,说法正确的是( )
2Z(气) △H<0,温度升高,气体平均相对分子质量减小,说法正确的是( )
A.X和Y可能都是固体 B.X和Y一定都是气体
C.若Y为固体,X一定是气体 D.X和Y不可能都是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
已知两个热化学方程式:C(s)+O2(g)==CO2(g) △H= ―393.5kJ/mol
2H2(g)+O2 (g)==2H2O(g) △H= ―483.6kJ/mol
(g)==2H2O(g) △H= ―483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是( )
A.1︰1 B.1︰2 C.2︰3 D.3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下向容积为20 L的密闭容器中充入1 mol NO2气体,发生反应2NO2N2O4。反应中测得相关数据如下表所示:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 气体相对分子质量 | 46 | 57 | 64 | 69 | 69 | 69 |
(1)此条件下该反应的化学平衡常数Kc=________。(填表达式)
 (2)在50 min末,向容器中加入 mol NO2,若要保持平衡不发生移动,则应加入N2O4________mol。
(2)在50 min末,向容器中加入 mol NO2,若要保持平衡不发生移动,则应加入N2O4________mol。
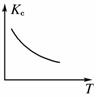
(3)若保持容器体积不发生变化,升高温度,则可得如图图像,据此判断该反应ΔH________0(填“大于”、“小于”或“等于”)。
(4)若在体积不变的情况下,开始充入0.5 mol N2O4,则达到新平衡时N2O4的转化率α=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
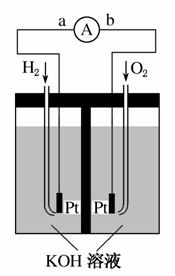
(1)氢氧燃料电池的能量转化主要形式是________________,在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为___________________________________。
(3)电极表面镀铂粉的原因为_________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2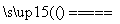 2LiH
2LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________。
②已知LiH固体密度为0.82 g/cm3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
两种金属混合物共15 g,投入足量的盐酸中,充分反应得11.2 L H2(标准状况),则原混合物组成中肯定不能为下列的( )
A.Mg、Ag B.Fe、Mg
C.Al、Zn D.Mg、Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com