
【题目】铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第I B族。Cu2+的核外电子排布式为__________。
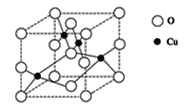
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为_____。
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______________。
(4)Cu2O的熔点比Cu2S的_________(填“高”或“低”)。
【答案】1s22s22p63s23p63d9 4 F电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强难以形成配位键,故NF3不易与Cu2+形成配位键 高
【解析】
(1) Cu电子排布式为: 1s22s22p63s23p63d104s1,在形成Cu2+的过程中,参与反应的电子是最外层的4s及3d上各一个电子,故Cu2+离子的电子排布式是为: 1s22s22p63s23p63d9;本题正确答案是: 1s22s22p63s23p63d9。
(2)从图中可以看出阴离子在晶胞有四类:顶点(8个)、棱上(4个)、面上(2个)、体心(1个),根据立方体的分摊法,可以知道该晶胞中阴离子数目为:,8![]() +4
+4![]() +1=4,本题正确答案是:4;
+1=4,本题正确答案是:4;
(3)因为N、F、H三种元素的电负性:F>N>H,所以N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强难以形成配位键,故NF3不易与Cu2+形成配位键。答案:F电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强难以形成配位键,故NF3不易与Cu2+形成配位键。
(4)因为氧离子的离子半径小于硫离子的离子半径,所带电荷数又相同,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高.因此,本题正确答案是:高。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的原因的是
A. 铜久置空气中表面出现绿色固体:2Cu+O2+CO2+H2O═Cu2(OH)2CO3
B. 某种火箭发射阶段有少量N2O4,逸出,产生红色气体:N2O4![]() 2NO2
2NO2
C. FeSO4·7H2O在空气中久置变黄:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O
D. SO2通入KMnO4溶液中,溶液紫色逐渐褪去:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4十2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
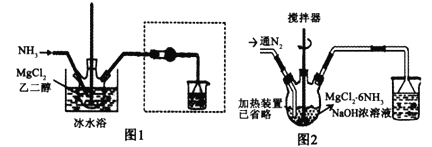
【题目】已知MgCl2+6NH3![]() MgCl2·6NH3该反应具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程实验装置如图1,放氨过程实验装置如图2。
MgCl2·6NH3该反应具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程实验装置如图1,放氨过程实验装置如图2。
己知:相关物质的性质见下表
物质名称 | 氨气的溶解性 | 氯化镁的溶解性 | 六氨氯化镁的溶解性 |
水 | 易溶 | 易溶 | 易溶 |
甲醇(沸点65。C) | 易溶 | 易溶 | 难溶 |
乙二醇(沸点197。C) | 易溶 | 易溶 | 难溶 |
请回答:
(1)实验室采用固固加热的方式制备NH3,制备反应的方程式为___________,虚框内装置的作用是___________,氨化过程采用冰水浴的原因可能是_____(填选项序号字母)。
A.氨化过程为吸热反应,促进反应正向进行
B.加快反应速率
C.防止氨气从溶液中挥发,提高氨气利用率
D.增大六氨氯化镁的溶解度
(2)利用MgCl2溶液制备无水MgCl2,其具体操作为______________________。
(3)进行放氨实验时,三颈烧瓶加入1.97 g MgCl2·6NH3和烧碱的浓溶液,加热,并不断通入N2,通入N2目的是___________。通过观察烧杯中现象的变化就可以监控MgCl2·6NH3的放氨过程,若要判断转化率是否达到或超过90%,则烧杯中溶液可以是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
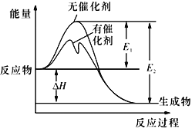
A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
C. 该反应中,反应物的总键能小于生成物的总键能
D. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目。____________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4—+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4—+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:______,MnO![]() +Fe2++H+=Mn2++Fe3++H2O
+Fe2++H+=Mn2++Fe3++H2O
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应正向反应过程中能量变化如图,下列说法正确的是
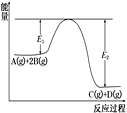
A. 该反应为吸热反应
B. 加入催化剂,反应速率增大,E1减小,E2减小,反应热不变
C. 增大压强,平衡正向移动,K增大
D. 当反应υ正(B)∶υ正(D)=2∶1时,到达平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着老百姓生活水平的提高,汽车进入寻常百姓家,在发生剧烈的汽车碰撞时,汽车安全气囊会发生反应10NaN3+2KNO3![]() K2O+5Na2O+16N2↑,有关该反应说法正确的是( )
K2O+5Na2O+16N2↑,有关该反应说法正确的是( )
A.氧化剂与还原剂的物质的量之比为5:1B.N2既是氧化产物也是还原产物
C.NaN3是氧化剂D.KNO3发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLNaOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。___
(2)若通入CO2气体为2.24L(标准状况下),得到9.5g的白色固体。
①请通过计算确定此白色固体组成为___。
②所用的NaOH溶液的物质的量浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取、净化并收集氯气涉及以下几个主要阶段:![]()
![]()
![]()
![]() 尾气处理
尾气处理
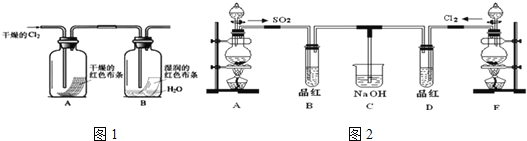
(1)写出实验室制取Cl2的离子方程式______________________,NA表示阿伏加德罗常数,若有4mol的HCl参加反应,则转移的电子总数为___________;
(2)现有以下3种试剂:A.饱和食盐水 B.浓硫酸 C.NaOH溶液
请在以上试剂中选择并回答填空:
X溶液应选用_________(填写序号);Y试剂的作用____________________.
(3)某化学兴趣小组为了探究Cl2的相关性质,设计了如图1的实验.
通入Cl2后,从观察集气瓶A、B中的现象可得出的结论是_____________(写出化学反应方程式,并用简要文字解释).
(4)某兴趣小组的同学为探究和比较SO2和氯水的漂白性,设计了如图2的实验装置.
①实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:______________________;
②反应开始一段时间后,观察到B、D两试管中的品红溶液都出现褪色的现象,但两者褪色原理不同,如何区别,请你帮助设计实验,你的操作是_________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com