
| A. | 元素周期表中有7个主族,7个副族 | |
| B. | VIA族元素原子的最外层电子数均为6 | |
| C. | 碳元素位于第二周期ⅣA族 | |
| D. | 氢分子中的化学键是极性共价键 |
分析 A.元素周期表中有7个主族,7个副族,1个0族,1个第Ⅷ族;
B.主族元素原子最外层电子数与族序数相等;
C.根据原子的核外电子排布判断;
D.氢气分子中存在H-H键,为非极性键.
解答 解:A.元素周期表中有18列,含有7个主族,7个副族,1个0族,1个第Ⅷ族(8、9、10列),故A正确;
B.主族元素原子最外层电子数与族序数相等,则VIA族元素原子的最外层电子数均为6,故B正确;
C.碳元素原子核外有2个电子层,最外层电子数为4,则位于第二周期ⅣA族,故C正确;
D.氢气分子中存在H-H键,两个原子吸引电子能力相同,则为非极性键,故D错误.
故选D.
点评 本题考查元素周期表的结构,为高频考点,侧重于双基的考查,难度较小,注意整体把握周期表结构与规律中的特殊性.


科目:高中化学 来源: 题型:解答题
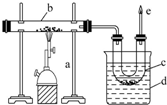 图是实验室干馏煤的装置图,回答下列问题:
图是实验室干馏煤的装置图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Na与乙醇反应比与水反应更剧烈 | |
| B. | 在催化剂存在下,乙醇能被氧气氧化成乙醛 | |
| C. | 乙酸能与碳酸氢钠溶液反应放出CO2 | |
| D. | 在浓硫酸存在下加热,乙酸能与乙醇反应生成乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
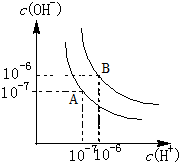 按要求填空:
按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
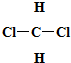 和
和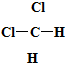 ⑥CH3CH2CH2CH3和
⑥CH3CH2CH2CH3和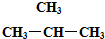
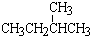 ;
; ③
③ .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com