
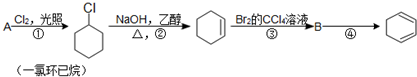
 ,名称是环己烷.
,名称是环己烷. .
. 分析 A和氯气发生取代反应生成1-氯环己烷,则A为 ,1-氯环己烷发生消去反应生成环己烯,环己烯和溴发生加成反应生成B,B结构简式为A为
,1-氯环己烷发生消去反应生成环己烯,环己烯和溴发生加成反应生成B,B结构简式为A为 ,
, 发生消去反应生成
发生消去反应生成 ,据此分析解答.
,据此分析解答.
解答 解:A和氯气发生取代反应生成1-氯环己烷,则A为 ,1-氯环己烷发生消去反应生成环己烯,环己烯和溴发生加成反应生成B,B结构简式为A为
,1-氯环己烷发生消去反应生成环己烯,环己烯和溴发生加成反应生成B,B结构简式为A为 ,
, 发生消去反应生成
发生消去反应生成 ,
,
(1)通过以上分析知,A的结构简式是 ,名称是环己烷,
,名称是环己烷,
故答案为: ;
;
(2)比A少2个碳原子的同系物中,其同分异构体是链烃的结构简式为CH3CH2CH=CH2、CH3CH=CHCH3、CH3C(CH3)=CH2,
故答案为:CH3CH2CH=CH2,CH3CH=CHCH3,CH3C(CH3)=CH2;
(3)通过以上分析知,①③的反应类型分别是取代反应、加成反应,
故答案为:取代反应;加成反应;
(4)该反应方程式为 ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,明确官能团及其性质关系是解本题关键,注意卤代烃发生取代反应和消去反应区别,题目难度不大.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b-a}{b}$ | B. | $\frac{2(b-a)}{b}$ | C. | $\frac{3a-2b}{b}$ | D. | $\frac{2b-3a}{b}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
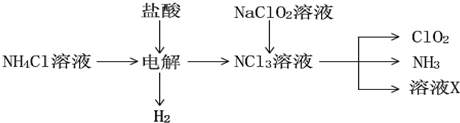
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

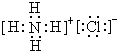
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
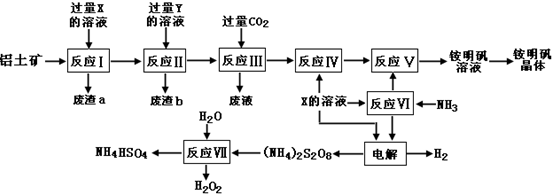
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 分子模型可以直观地表现分子结构的特点.如图表示某烃分子的一种模型,有关说法中正确的是( )
分子模型可以直观地表现分子结构的特点.如图表示某烃分子的一种模型,有关说法中正确的是( )| A. | 该图表示的是乙烯分子的球棍模型 | |
| B. | 该烃分子是非极性分子 | |
| C. | 该烃的电子式为: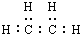 | |
| D. | 该烃分子中半径较大的原子其核外电子排布的轨道表示式为: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com