
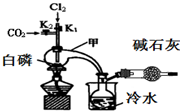
 三氯化磷($\stackrel{+3}{P}$Cl3)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质.PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料.
三氯化磷($\stackrel{+3}{P}$Cl3)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质.PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
分析 I.(1)干燥管中碱石灰的作用是吸收多余的氯气和空气中的水蒸气,以防止空气中的水蒸气进入装置使PCl3水解;
(2)PCl3强烈水解的产物是H3PO3和HCl,H3PO3是弱酸,HCl是强酸,据此分析;
(3)根据表格提供的信息,物质互溶且熔沸点不同,除去PCl3中的POCl3选用的方法是蒸馏法;
II.(1)若将0.01 mol POCl3投入热水配成1 L的溶液,发生的化学反应为POCl3+H2O=H3PO4+3HCl,生成0.03molHCl和0.01molH3PO4,加入2.4g即0.06molNa0H,恰好与生成的酸反应得到NaCl、Na3PO4溶液,其溶液分别为0.03mol/L、0.01 mol/L,结合各自的Ksp的值可计算得产生沉淀时所需银离子的浓度,据此判断;
(2)①用cmol/LNH4SCN溶液滴定过量Ag+至终点时,溶液中应有稍过量的NH4SCN,NH4SCN遇到铁离子能出现血红色,据此答题;
②实验过程中加入硝基苯的目的是覆盖氯化银,防止沉淀转化生成AgSCN而导致数据不准确,如无此操作,则消耗的NH4SCN溶液的体积偏大,据此判断;
③根据题 意可知,NH4SCN的物质的量为bc×10-3 mol,据此可计算出与之反应的银离子的物质的量为bc×10-3 mol,而总银离子的物质的量为0.1000mol/L×0.04L=0.004mol,所以与氯离子反应的银离子的物质的量为0.004mol-bc×10-3 mol,所以氯离子的物质的量为0.004mol-bc×10-3 mol,据此计算产品中Cl元素的含量;
解答 解:I.(1)干燥管中碱石灰的作用是吸收多余的氯气和空气中的水蒸气,以防止空气中的水蒸气进入装置使PCl3水解,
故答案为:吸收多余的氯气和空气中的水蒸气;
(2)PCl3强烈水解的产物是H3PO3和HCl,H3PO3是二元弱酸:H3PO3?H++H2PO3-,H2PO3-?H++HPO32-,HCl是强酸,所以PC13遇水所得溶液中除OH-之外其它离子的浓度由大到小的顺序是c(H+)>c(Cl-)>c(H2c3-)>c(Hc32-),
故答案为:c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-);
(3)根据表格提供的信息,它们互溶且熔沸点不同,所以除去PCl3中的POCl3制备纯净的PCl3可选用的方法是蒸馏法,故选:C;
II.(1)若将0.01 mol POCl3投入热水配成1 L的溶液,发生的化学反应为POCl3+H2O=H3PO4+3HCl,生成0.03molHCl和0.01molH3PO4,加入2.4g即0.06molNa0H,恰好与生成的酸反应得到NaCl、Na3PO4溶液,其溶液分别为0.03mol/L、0.01 mol/L,产生Ag3PO4沉淀时,溶液中银离子的浓度为$\root{3}{\frac{Ksp(Ag{\;}_{3}PO{\;}_{4})}{c(P{{O}_{4}}^{3-})}}$=$\root{3}{\frac{1.4×10{\;}^{-16}}{0.01}}$mol/L=$\root{3}{14}$×10-5 mol/L,产生AgCl沉淀时,溶液中银离子的浓度为$\frac{K{\;}_{sp(AgCl)}}{c(C{l}^{-})}$=$\frac{1.8×10{\;}^{-10}}{0.03}$mol/L=6×10-9 mol/L,所以产生氯化银沉淀时所需银离子的浓度小,也就先产生沉淀,
故答案为:AgCl;
(2)①用cmol/LNH4SCN溶液滴定过量Ag+至终点时,溶液中应有稍过量的NH4SCN,NH4SCN遇到铁离子能出现血红色,故选B,滴定终点的现象为溶液由无色变为血红色,且30s不褪色,
故答案为:B;溶液由无色变为血红色,且30s不褪色;
②实验过程中加入硝基苯的目的是覆盖氯化银,防止沉淀转化生成AgSCN而导致数据不准确,如无此操作,则消耗的NH4SCN溶液的体积偏大,根据题中的计算原理 可知,氯离子溶液偏小,
故答案为:偏小;
③根据题 意可知,NH4SCN的物质的量为bc×10-3 mol,据此可计算出与之反应的银离子的物质的量为bc×10-3 mol,而总银离子的物质的量为0.1000mol/L×0.04L=0.004mol,所以与氯离子反应的银离子的物质的量为0.004mol-bc×10-3 mol,所以氯离子的物质的量为0.004mol-bc×10-3 mol,所以产品中Cl元素的含量为$\frac{(0.004mol-bc×10{\;}^{-3}mol)×35.5g/mol}{ag}$=$\frac{35.5(4-bc)}{1000a}$,
故答案为:$\frac{35.5(4-bc)}{1000a}$.
点评 本题考查氯气的实验室制法、PCl3的制备、离子浓度的大小比较、沉淀溶解平衡、沉淀滴定等知识,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 除去HCl溶液中的少量H2SO4,可加入适量Ba(NO3)2溶液后过滤 | |
| B. | 除去铁粉中的少量铝粉,可加入适量稀盐酸后过滤 | |
| C. | 除去FeCl3溶液中的少量CuCl2,可加入适量铁粉后过滤 | |
| D. | 除去Na2CO3固体中的少量NaHCO3,可将固体加热至恒重 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁片和稀硫酸反应制取氢气时,改用9.8%的浓硫酸可以加快产生氢气的速率 | |
| B. | 10.0 mL 2 molL -1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | SO 2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢 | |
| D. | 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(B2-)+c(HB-)+c(H2B)=0.1 mol/L | B. | c(Na+)+c(H+)=c(OH-)+c(HB-)+c(B2-) | ||
| C. | c(OH-)=c(H+)+c(HB-) | D. | c(Na+)=2c(B2-)+c(HB-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g | B. | 16g | C. | 24g | D. | 48g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com